
Wetenschap
Lego-achtige chemische bouwstenen die zichzelf assembleren tot katalysator voor waterstofbrandstofcellen

De nieuwe katalysator een cofaciale kobaltporfyrine, wordt gemaakt met behulp van een proces dat moleculaire zelfassemblage wordt genoemd. Tijdens dit proces, een injectieflacon gevuld met moleculen die kobaltporfyrinen worden genoemd (flacon aan de linkerkant) worden gemengd met een injectieflacon met 'clips' van ruthenium (flacon in het midden). Het eindproduct, de cofaciale kobaltporfyrinekatalysator, is afgebeeld in de flacon aan de rechterkant. Credit:Douglas Levere/Universiteit in Buffalo
Wat is er beter dan platina?
In waterstofbrandstofcellen, het antwoord is cofaciale kobaltporfyrines.
Het is een mondvol om te zeggen, en als je geen scheikundige bent, je hebt waarschijnlijk nog nooit van deze verbindingen gehoord. Maar deze moleculen - die geweldig zijn in het faciliteren van een chemische reactie die nodig is om energie te produceren uit waterstof en zuurstof - zouden de volgende grote stap voorwaarts kunnen zijn in alternatieve energie.
De verbindingen assembleren zichzelf in het laboratorium uit Lego-achtige chemische bouwstenen die zijn ontworpen om in elkaar te passen. Het is shake-and-bake-technologie:wetenschappers voegen de stukjes toe aan een kolf, roer ze door elkaar en voeg warmte toe. Overuren, de bouwstenen komen op de juiste plaatsen samen om de uiteindelijke complexen te vormen.
Het materiaal is goedkoop en gemakkelijk in grote hoeveelheden te produceren. Dit maakt het een ideale kandidaat voor het vervangen van kostbare platinakatalysatoren die tegenwoordig in waterstofbrandstofcellen worden gebruikt, zegt Timothy Cook, doctoraat, assistent-professor scheikunde aan de universiteit van Buffalo College of Arts and Sciences, wiens team de nieuwe zelf-geassembleerde verbindingen heeft ontworpen.
Een dergelijke technologie zou autofabrikanten ooit in staat kunnen stellen de prijs van waterstofauto's te verlagen, waardoor de milieuvriendelijke voertuigen voor meer consumenten binnen handbereik komen. Goedkope brandstofcellen kunnen ook de ontwikkeling van andere door waterstof aangedreven apparaten stimuleren. zoals back-upgeneratoren. Waterstof wordt beschouwd als een schone energiebron omdat brandstofcellen alleen water als bijproduct uitstoten.
"Om de prijs van waterstofvoertuigen te verlagen en ze een realistische optie te maken voor meer mensen, we hebben een katalysator nodig die goedkoper is dan platina, Cook zegt. "De katalysator die we hebben gemaakt, kan in enorme hoeveelheden zelf worden geassembleerd. Het bevat ruthenium en kobalt - veel goedkopere metalen - en, nog, het werkt net zo goed of beter dan een commercieel verkrijgbare platinakatalysator die we ernaast hebben getest."
Een studie die het nieuwe materiaal beschrijft, werd op 29 mei gepubliceerd in Chemie:een Europees tijdschrift . Cook's co-auteurs waren onder meer eerste auteur Amanda N. Oldacre, een recente UB chemie Ph.D. afstuderen; UB scheikunde Ph.D. leerling Matthew R. Crawley; en Alan E. Friedman, doctoraat, universitair hoofddocent materiaalontwerp en innovatie aan de UB School of Engineering and Applied Sciences.
Een zelfproducerende katalysator
Cook's lab is gespecialiseerd in moleculaire zelfassemblage, een krachtig proces voor het maken van nieuwe materialen.
"Als ik denk aan moleculaire zelfassemblage, Ik denk altijd aan Lego, "zegt hij. "Je hebt bouwstenen die zijn ontworpen om in elkaar te passen, als stukjes van een puzzel. Deze bouwstenen worden tot elkaar aangetrokken, en als je ze samenvoegt en energie toevoegt, ze komen vanzelf bij elkaar.

Een rondbodemkolf gevuld met cofaciale kobaltporfyrine, een nieuwe katalysator voor waterstofbrandstofcellen. Credit:Douglas Levere/Universiteit in Buffalo
"Zelfassemblage is een geweldige manier om een complex molecuul te maken. Meestal om een nieuw materiaal te synthetiseren, je moet stukjes één voor één toevoegen, wat tijd en geld kost. Moleculaire zelfassemblage is sneller - het is een proces in één stap."
Cofaciale kobaltporfyrinen bestaan uit twee platte moleculen die kobaltporfyrinen worden genoemd, die op elkaar zijn gestapeld als sandwichbrood en verbonden door ruthenium "clips".
Om de uiteindelijke verbindingen te maken, Cook's lab ontwierp porfyrines en clips met chemische eigenschappen die ervoor zorgden dat ze op de juiste plekken met elkaar zouden verbinden. Het team mengde vervolgens een oplossing van de porfyrines met de clips en voegde warmte toe. Binnen twee dagen, de stukken waren zelf geassembleerd om de cofaciale kobaltporfyrinen te vormen.
Een katalysator geïnspireerd door de natuur
Net als de platinakatalysator zijn ze ontworpen om te vervangen, de cofaciale kobaltporfyrinen vergemakkelijken een chemische reactie in waterstofbrandstofcellen die zuurstofreductie wordt genoemd. Dit omvat het splitsen van een zuurstofmolecuul in twee afzonderlijke zuurstofatomen die vervolgens kunnen binden met waterstof om water te vormen - een interactie die energie produceert.
Wetenschappers weten al lang dat porfyrines goed zijn in het opnemen en splitsen van zuurstof:in het menselijk lichaam, op ijzer gebaseerde versies van deze moleculen zijn verantwoordelijk voor het helpen omzetten van de zuurstof die we inademen in water, daarbij energie vrijmaken, zegt kok.
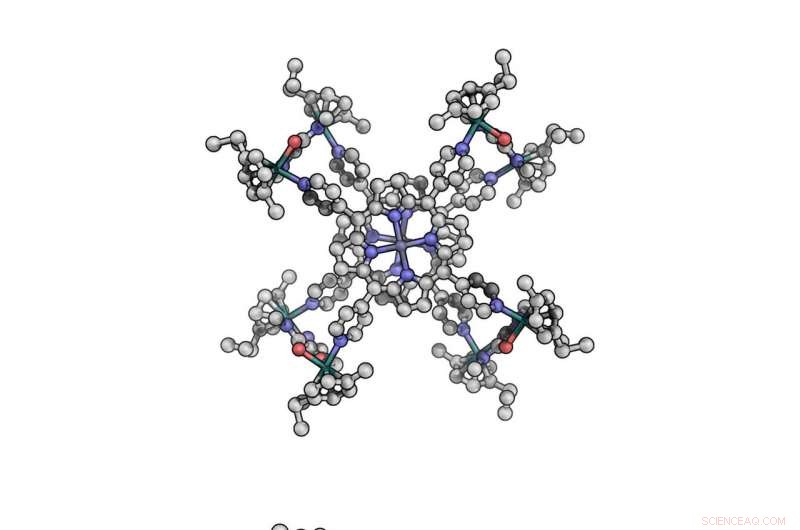
De nieuwe katalysator een cofaciale kobaltporfyrine, vanuit verschillende perspectieven getoond. De verbinding bestaat uit twee platte moleculen, kobaltporfyrinen genaamd, die als boterhammen op elkaar zijn gestapeld en met elkaar zijn verbonden door 'clips' van ruthenium. Krediet:Matthew Crawley
Maar het ontwerpen van kunstmatige porfyrinestructuren die als katalysatoren fungeren, was moeilijk, hij voegt toe. Het proces om deze verbindingen te maken is meestal duur, met veel stappen en uiteindelijk weinig materiaal.
Zelfassemblage lost deze problemen op:Cook's team creëerde 79 gram cofaciale kobaltporfyrines voor elke 100 gram startmateriaal - veel beter dan de minder dan 1 procent opbrengst die andere laboratoria hebben gerapporteerd bij het synthetiseren van vergelijkbare materialen. In aanvulling, zijn team kon gemakkelijk rutheniumclips van verschillende lengtes verwisselen en testen om de elektrochemische eigenschappen van de verbinding te verfijnen met het oog op het ontwerpen van een ideale katalysator.
"Het is echt de moeite waard om te werken aan de fundamentele chemie van dit project, die een grote impact kunnen hebben op de CO2-neutrale energieconversie, " zegt Oldacre, de eerste auteur. "Met behulp van zelfassemblagetechnieken, we zijn in staat om goedkopere materialen te maken in 48 uur, zonder de moeilijke, tijdrovende zuiveringsstappen die andere methoden voor het synthetiseren van nieuwe verbindingen vereisen."
 Voorgespannen pleisters voor oude gebouwen
Voorgespannen pleisters voor oude gebouwen Ongebruikelijke biosynthetische route biedt een sleutel tot toekomstige ontdekking van natuurlijke producten
Ongebruikelijke biosynthetische route biedt een sleutel tot toekomstige ontdekking van natuurlijke producten Een onzichtbaar sleutelgat via transparante elektronica
Een onzichtbaar sleutelgat via transparante elektronica Chemici testen het vermogen van Chemica om synthetische routes te genereren
Chemici testen het vermogen van Chemica om synthetische routes te genereren 3D-geprint apparaat vindt naald in hooiberg kankercellen door hooi te verwijderen
3D-geprint apparaat vindt naald in hooiberg kankercellen door hooi te verwijderen
 Natuurbeschermers merken dat beschermde gebieden wereldwijd krimpen
Natuurbeschermers merken dat beschermde gebieden wereldwijd krimpen Oceaanstroomsysteem lijkt een kantelpunt te naderen
Oceaanstroomsysteem lijkt een kantelpunt te naderen Californië is abnormaal droog na winter met weinig neerslag
Californië is abnormaal droog na winter met weinig neerslag Emissierechtensysteem voor bouwmaterialen meest kosteneffectieve manier om koolstof te verminderen
Emissierechtensysteem voor bouwmaterialen meest kosteneffectieve manier om koolstof te verminderen Inzichten in gedrag tijdens schoorsteenbrand Tops 2 kunnen evacuatieplanning verbeteren
Inzichten in gedrag tijdens schoorsteenbrand Tops 2 kunnen evacuatieplanning verbeteren
Hoofdlijnen
- Cellulaire ademhaling bij de mens
- Kennis van larvale vissen slechts een druppel op de gloeiende plaat
- Waar zijn spiervezels van gemaakt?
- Hoe extremofielen werken
- Waarom blozen mensen?
- Een bacterieel stroomdiagram maken
- Hoe werkt het spierenstelsel met de bloedsomloop?
- 85 nieuwe soorten beschreven door de California Academy of Sciences in 2017
- Landbouwparasiet neemt de genen van waardplanten over
- Zoals de hond van Pavlov, deze thermoplast leert een nieuwe truc:lopen

- Wetenschappers creëren unieke legering voor lucht, spoorvervoer

- Wetenschappers ontdekken structuur van door licht aangedreven enzym met mogelijke toepassingen voor biobrandstof
- Met behulp van computationele chemie om goedkopere infrarood plastic lenzen te produceren

- Elektronisch afval verpulveren is groen, schoon en koud

 Race om kilowatt leegt Bosnisch meer
Race om kilowatt leegt Bosnisch meer Titratie van natriumcarbonaat met zoutzuur
Titratie van natriumcarbonaat met zoutzuur Onderzoekers vergroten toegang tot 3D-modellering via aanraakscherm
Onderzoekers vergroten toegang tot 3D-modellering via aanraakscherm De uitdaging om nieuwe nanostructurele bimetaalcomposiet voor katalyse te presenteren
De uitdaging om nieuwe nanostructurele bimetaalcomposiet voor katalyse te presenteren Nieuwe methode voor synthese van moleculaire waterstof stelt maatstaf voor platinavrije elektrokatalysatoren
Nieuwe methode voor synthese van moleculaire waterstof stelt maatstaf voor platinavrije elektrokatalysatoren Noordelijkste koraalrif ter wereld in Japan verbleekt
Noordelijkste koraalrif ter wereld in Japan verbleekt Nanogestructureerde gate-diëlektricum verhoogt de stabiliteit van organische dunnefilmtransistors
Nanogestructureerde gate-diëlektricum verhoogt de stabiliteit van organische dunnefilmtransistors Minipsyches geven inzicht in mysterieuze metaalrijke nabije-aarde-asteroïden
Minipsyches geven inzicht in mysterieuze metaalrijke nabije-aarde-asteroïden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

