
Wetenschap
Computer op nanoschaal regelt functie van eiwit, beïnvloedt celgedrag
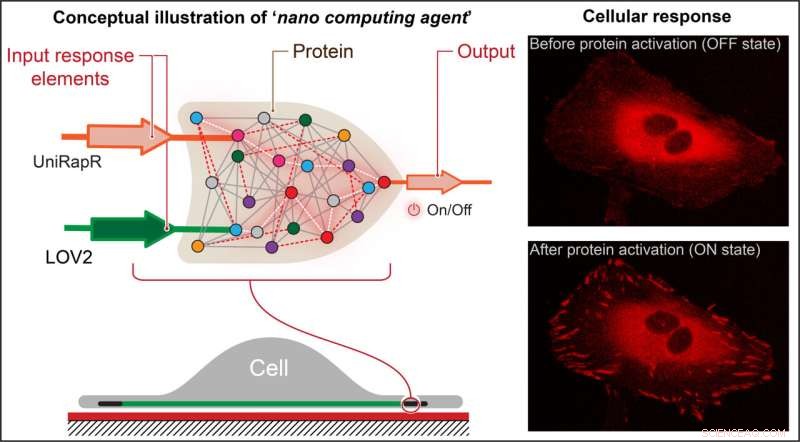
Onderzoekers creëerden een transistorachtige 'logische poort', een soort computerbewerking waarbij meerdere ingangen een uitvoer besturen en deze in een eiwit inbedden. Ze ontdekten dat ze het eiwit niet alleen snel konden activeren met behulp van licht en het medicijn rapamycine, maar ook dat deze activering ertoe leidde dat de cellen interne veranderingen ondergingen die hun adhesieve vermogens verbeterden, wat uiteindelijk hun beweeglijkheid verminderde. Krediet:Penn State
De creatie van computers op nanoschaal voor gebruik in precisiegezondheidszorg is al lang een droom van veel wetenschappers en zorgverleners. Nu hebben onderzoekers van Penn State voor het eerst een nanocomputingmiddel geproduceerd dat de functie van een bepaald eiwit kan controleren dat betrokken is bij celbeweging en kankermetastase. Het onderzoek maakt de weg vrij voor de bouw van complexe computers op nanoschaal voor de preventie en behandeling van kanker en andere ziekten.
Nikolay Dokholyan, G. Thomas Passananti Professor, Penn State College of Medicine, en zijn collega's - waaronder Yashavantha Vishweshwaraiah, postdoctoraal wetenschapper in farmacologie, Penn State - creëerden een transistorachtige 'logische poort', een soort computerbewerking waarbij meerdere ingangen besturen een uitgang.
"Onze logische poort is nog maar het begin van wat je cellulair computergebruik zou kunnen noemen," zei hij, "maar het is een belangrijke mijlpaal omdat het het vermogen aantoont om voorwaardelijke bewerkingen in een eiwit in te bedden en de functie ervan te beheersen", zei Dokholyan. "Het zal stellen ons in staat een dieper inzicht te krijgen in de menselijke biologie en ziekte en introduceert mogelijkheden voor de ontwikkeling van precisietherapieën."
De logische poort van het team bestond uit twee sensordomeinen die zijn ontworpen om te reageren op twee inputs:licht en het medicijn rapamycine. Het team richtte zich op het eiwit focale adhesiekinase (FAK) omdat het betrokken is bij celadhesie en -beweging, wat de eerste stappen zijn in de ontwikkeling van uitgezaaide kanker.
"Eerst introduceerden we een rapamycine-gevoelig domein, uniRapr genaamd, dat het lab eerder had ontworpen en bestudeerd, in het gen dat codeert voor FAK," zei Vishweshwaraiah. "Vervolgens introduceerden we het domein, LOV2, dat gevoelig is voor licht. Nadat we beide domeinen hadden geoptimaliseerd, hebben we ze gecombineerd tot één definitief ontwerp met logische poorten."
Het team bracht het gemodificeerde gen in HeLa-kankercellen in en observeerde de cellen met behulp van confocale microscopie in vitro. Ze bestudeerden de effecten van elk van de inputs afzonderlijk, evenals de gecombineerde effecten van de inputs, op het gedrag van de cellen.
Ze ontdekten dat ze niet alleen FAK snel konden activeren met licht en rapamycine, maar ook dat deze activering ertoe leidde dat de cellen interne veranderingen ondergingen die hun adhesievermogen verbeterden, wat uiteindelijk hun beweeglijkheid verminderde.
Hun resultaten zijn vandaag (16 november) gepubliceerd in het tijdschrift Nature Communications .
"We laten voor het eerst zien dat we een functionerend nanocomputermiddel in levende cellen kunnen bouwen dat het celgedrag kan controleren", zei Vishweshwaraiah. "We hebben ook enkele interessante eigenschappen van het FAK-eiwit ontdekt, zoals de veranderingen die het in cellen teweegbrengt wanneer het wordt geactiveerd."
Dokholyan merkte op dat het team hoopt deze nanocomputermiddelen uiteindelijk in vivo te testen in levende organismen.
Andere auteurs van Penn State op het papier zijn Jiaxing Chen, afgestudeerde student; Venkat R. Chirasani, postdoctoraal onderzoeker; en Erdem D. Tabdanov, assistent-professor farmacologie. + Verder verkennen
Cellen veranderen in computers met logische eiwitpoorten
 Dalian Coherent Light Source onthult nieuwe dissociatiekanalen in ethaanfotochemie
Dalian Coherent Light Source onthult nieuwe dissociatiekanalen in ethaanfotochemie Onderzoek naar levensvatbare, veilige batterijen overwinnen hoge weerstand, halfgeleiderbarrières met lage capaciteit
Onderzoek naar levensvatbare, veilige batterijen overwinnen hoge weerstand, halfgeleiderbarrières met lage capaciteit Helder en efficiënt licht zonder zeldzame metalen
Helder en efficiënt licht zonder zeldzame metalen Nieuwe kristallijne ijsvorm:wetenschappers verhelderen kristalstructuur voor exotisch ijs XIX
Nieuwe kristallijne ijsvorm:wetenschappers verhelderen kristalstructuur voor exotisch ijs XIX De universele taal van hormonen
De universele taal van hormonen
 Methaanuitstootpiek:is er één grote boosdoener?
Methaanuitstootpiek:is er één grote boosdoener? Vragen dwarrelen over Portugal brandt weg des doods
Vragen dwarrelen over Portugal brandt weg des doods Indonesische aardbeving en tsunami verwoesten kust, veel slachtoffers
Indonesische aardbeving en tsunami verwoesten kust, veel slachtoffers De omvang van tsunami's afleiden uit de ronding van afgezet grind
De omvang van tsunami's afleiden uit de ronding van afgezet grind Hoeveel sneeuw hoopt zich er elk jaar op in Noord-Amerika? Meer dan wetenschappers dachten
Hoeveel sneeuw hoopt zich er elk jaar op in Noord-Amerika? Meer dan wetenschappers dachten
Hoofdlijnen
- Soorten organellen
- Duiven beter in multitasken dan mensen:studie
- Onderzoekers ontdekken uitgestorven prehistorisch reptiel dat tussen dinosauriërs leefde
- Onderzoekers brengen dramatische achteruitgang in genetische diversiteit van noordwestelijke zalm in kaart
- Wat zijn de meest zichtbare kleuren van een afstand?
- Een AI-berichtendecoder op basis van bacteriegroeipatronen
- Wolven bleken meer coöperatief te zijn met hun eigen soort dan honden met die van hen
- Wat is het verschil tussen hardhout en zachthout?
- Waarom liegen we?
- Terahertz-wetenschap onthult de ultrasnelle dynamiek van fotodragers in koolstofnanobuisjes
- Op grafeen gebaseerde nanozyme helpt bij het detecteren van L-cysteïne in serum

- Nanobuiscoating helpt massaspectrometers te verkleinen

- De norm op nanodraden buigen
- Voor 2-D boor, het draait allemaal om die basis

 Duitse autoverkopen hoger in juli
Duitse autoverkopen hoger in juli Het vinden van orde in wanorde toont een nieuwe staat van materie aan
Het vinden van orde in wanorde toont een nieuwe staat van materie aan Duitslands Bosch maakt gebruik van de Amerikaanse forenzen-app
Duitslands Bosch maakt gebruik van de Amerikaanse forenzen-app Het geschatte product van een gemengde fractie vinden
Het geschatte product van een gemengde fractie vinden Natuurkunde laat zien dat imperfecties perfect zijn
Natuurkunde laat zien dat imperfecties perfect zijn Zes wolken die je moet kennen - en wat ze kunnen onthullen over het weer
Zes wolken die je moet kennen - en wat ze kunnen onthullen over het weer Verschillen tussen waterlichamen
Verschillen tussen waterlichamen Waarom is fotosynthese zo belangrijk voor planten?
Waarom is fotosynthese zo belangrijk voor planten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

