
Wetenschap
Nieuwe screeningtechniek kan mRNA-therapieën versnellen en verbeteren
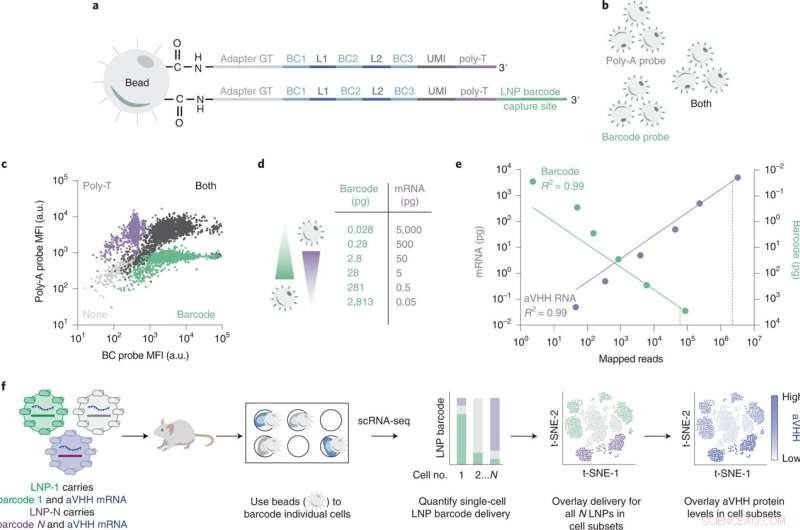
SENT-seq gebruikt orthogonale opnamesequenties om afstembare multiomische uitlezingen te genereren. Krediet:Natuurnanotechnologie (2022). DOI:10.1038/s41565-022-01146-9
Therapeutica op basis van messenger-RNA, of mRNA, kunnen potentieel een breed scala aan ziekten behandelen, waaronder kanker, genetische ziekten en, zoals de wereld de afgelopen jaren heeft geleerd, dodelijke virussen.
Om te werken, moeten deze medicijnen rechtstreeks aan de doelcellen worden afgeleverd in bubbels van vet op nanoschaal die lipidenanodeeltjes of LNP's worden genoemd - mRNA is niet veel goeds als het niet het juiste celtype bereikt.
Een team van onderzoekers van het Georgia Institute of Technology en de Emory University's School of Medicine heeft een nieuwe stap gezet in de richting van het verbeteren van de ontwikkeling van deze op maat gemaakte leveringsvoertuigen, en rapporteert hun werk op 30 juni in Nature Nanotechnology . Curtis Dobrowolski en Kalina Paunovska, stagiaires in het lab van James Dahlman, hebben een systeem ontwikkeld om preklinische nanodeeltjesstudies voorspellender te maken. Hun ontdekkingen beïnvloeden nu al de richting van het onderzoek in dit groeiende, competitieve veld.
"Ik ben erg enthousiast over deze studie en verwacht dat we de meeste van onze toekomstige projecten naar deze methodologie zullen verschuiven", zegt Dahlman, universitair hoofddocent en McCamish Foundation Early Career Professor in de Wallace H. Coulter Department of Biomedical Engineering bij Georgia Tech en Emory.
Opeenvolging van gebeurtenissen
De afgelopen jaren heeft Dahlman samengewerkt met Coulter BME-professor Philip Santangelo in een druk onderzoeksbedrijf. Het laboratorium van Santangelo ontwikkelt mRNA-therapieën en het laboratorium van Dahlman levert het met behulp van LNP's.
Om het proces van het testen van de effectiviteit van hun LNP's te versnellen, heeft het team van Dahlman een techniek ontwikkeld die DNA-barcoding wordt genoemd. In dit proces voegen onderzoekers een stukje DNA in dat overeenkomt met een bepaalde LNP. De LNP's worden vervolgens geïnjecteerd en cellen worden vervolgens onderzocht op de aanwezigheid van de "barcodes" met behulp van genetische sequencing. Het systeem identificeert welke streepjescodes welke specifieke doelen hebben bereikt en benadrukt de meest veelbelovende nanodeeltjes. Omdat veel DNA-sequenties tegelijk kunnen worden gelezen, maakt het barcoderingsproces het mogelijk om veel experimenten tegelijkertijd uit te voeren, waardoor de ontdekking van effectieve dragers van lipidenanodeeltjes wordt versneld.
DNA-barcodering heeft het preklinische screeningproces van nanodeeltjes aanzienlijk verbeterd. Maar er is nog steeds een belangrijke barrière die de toediening van medicijnen beïnvloedt. Vanwege hun diversiteit zijn cellen een soort bewegende doelen. Dahlman merkte op dat cellen die eerder als homogeen werden beschouwd, zijn samengesteld uit verschillende en gevarieerde celsubsets. Zijn team vermoedde dat deze chemische en genetische heterogeniteit een krachtige invloed heeft op hoe goed LNP's mRNA-therapieën in de cellen kunnen afleveren.
"Cellen hebben niet slechts één eiwit dat ze definieert - ze zijn gecompliceerd," zei Dahlman. "Ze kunnen worden gedefinieerd door een combinatie van dingen, en als we eerlijk zijn, kunnen ze het beste worden gedefinieerd met behulp van alle genen die ze wel of niet tot expressie brengen."
Om hun hypothese te testen, ontwikkelden de onderzoekers een nieuwe tool om al deze dingen tegelijk te meten. Hun multiomic nanodeeltjesafgiftesysteem wordt single-cell nanoparticle targeting-sequencing of SENT-seq genoemd.
Multiomics-aanpak
Met behulp van SENT-seq konden de onderzoekers kwantificeren hoe LNP's DNA-barcodes en mRNA in cellen afleveren, de daaropvolgende eiwitproductie mogelijk gemaakt door het mRNA-medicijn, evenals de identiteit van de cel, in duizenden individuele cellen.
Deze multiomics-aanpak zou een belangrijke sprong voorwaarts kunnen betekenen voor LNP-ontdekking met hoge doorvoer. Dankzij de SENT-seq-techniek kon het team celsubtypes identificeren die een bijzonder hoge of lage opname van nanodeeltjes vertonen, en de genen die bij die subtypes horen.
Dus, naast het testen van de werkzaamheid van een medicijn en hoe bepaalde celsubtypes reageren op nanodeeltjes, identificeren ze welke genen betrokken zijn bij de succesvolle opname van LNP's. En ze doen het allemaal tegelijk.
"The data suggests that these different cell subsets have distinct responses to nanoparticles that influence how well an mRNA therapy works," Dahlman said. "There's still a lot of work to be done, but we think the ability to simultaneously read out high-throughput nanoparticle delivery and the cellular response to nanoparticles will lead to better mRNA therapies."
Co-lead author Paunovska said that she and Dobrowolski came up with the idea for the SENT-seq system, "organically, after two months of working together."
Dahlman added:"I'm proud of the work that Curtis, Kalina, and the team did in the lab. I think this is the beginning of an extremely interesting phase in our work." + Explore further
New system speeds screening of drug-delivering nanoparticles
 Steenkool onthult een verfijnde kant:vuile koolstof kan worden gebruikt om een verscheidenheid aan nuttige apparaten te maken
Steenkool onthult een verfijnde kant:vuile koolstof kan worden gebruikt om een verscheidenheid aan nuttige apparaten te maken Digitale penicillineproductie
Digitale penicillineproductie Energie-efficiënte fotochemie op zonne-energie met luminescente zonneconcentratoren
Energie-efficiënte fotochemie op zonne-energie met luminescente zonneconcentratoren Jane Austen-citaat gecodeerd in een polymeer
Jane Austen-citaat gecodeerd in een polymeer Een nieuw regime voor het analyseren van eigenschappen van topologische materialen
Een nieuw regime voor het analyseren van eigenschappen van topologische materialen
 Benzinestations laten veel meer giftige dampen ontsnappen dan eerder werd gedacht
Benzinestations laten veel meer giftige dampen ontsnappen dan eerder werd gedacht TransCanada dient Amerikaanse aanvraag in om Keystone-pijplijn te bouwen
TransCanada dient Amerikaanse aanvraag in om Keystone-pijplijn te bouwen Dingen gemaakt van rubber
Dingen gemaakt van rubber Luchtvervuiling aanpakken:onderzoekers presenteren emissie-inventaris voor Nepal
Luchtvervuiling aanpakken:onderzoekers presenteren emissie-inventaris voor Nepal Vissen in de rivier die beroemd in brand vloog, nu OK voor het avondeten
Vissen in de rivier die beroemd in brand vloog, nu OK voor het avondeten
Hoofdlijnen
- Sahelanthropus, de oudste vertegenwoordiger van de mensheid, was inderdaad tweevoetig
- Wat zijn de vijf onderverdelingen van koninkrijken?
- Organische materie speelt een sleutelrol bij stikstofverlies door modderige/zandige sedimenten op de kust van de Oost-Chinese Zee
- Levensduur verlengd door remming van gemeenschappelijk enzym
- Roofzuchtige bacteriën gevonden in studie van longmicrobioom van patiënten met cystische fibrose
- Hoe zijn dieren en planten vergelijkbaar?
- Een aap en een virus:een miljoen jaar samen
- Hoe doorlatendheid te berekenen
- Waardoor stinkt de durian-vrucht? Kankerwetenschappers kraken het durian-genoom
- Magnetisme en licht combineren om kanker te bestrijden
- Wondermateriaal:voor het eerst individuele 2-D fosforeen nanolinten gemaakt

- Nieuwe analyse van 2D-perovskieten zou de toekomst van zonnecellen en LED's kunnen bepalen
- Onderzoekers ontwerpen driedimensionale kirigami-bouwstenen om dynamische metamaterialen te maken

- Dunne films van perovskietoxiden zijn veelbelovend voor het schrijven van gegevens op terahertz-frequentie

 Alkaline Water Definitie
Alkaline Water Definitie  Onze atoombewegende laser beeldhouwt materie in vreemde nieuwe vormen - nieuw onderzoek
Onze atoombewegende laser beeldhouwt materie in vreemde nieuwe vormen - nieuw onderzoek Diverse bossen zijn sterker tegen droogte
Diverse bossen zijn sterker tegen droogte De oorspronkelijke architectuur van het zonnestelsel reconstrueren
De oorspronkelijke architectuur van het zonnestelsel reconstrueren Hoe moessonwinden de klimaatverandering beïnvloeden door verontreinigende stoffen naar de hogere atmosfeer te transporteren
Hoe moessonwinden de klimaatverandering beïnvloeden door verontreinigende stoffen naar de hogere atmosfeer te transporteren Zeespiegel voor Nederlandse kust hoogste ooit gemeten in 2017
Zeespiegel voor Nederlandse kust hoogste ooit gemeten in 2017 Hoe een 120V AC naar 12V DC Power Converter
Hoe een 120V AC naar 12V DC Power Converter SpaceX lanceert vracht, maar slaagt er niet in om raket te landen
SpaceX lanceert vracht, maar slaagt er niet in om raket te landen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

