
Wetenschap
Hete elektronen doen het onmogelijke in de katalytische chemie
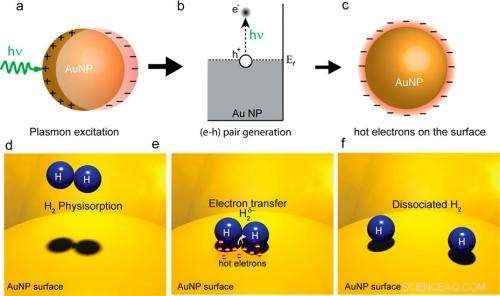
In een), (B), en C), oppervlakteplasmonen die door een laser worden geëxciteerd, genereren hete elektronen op een gouden nanodeeltjesoppervlak. In (d), (e), en (v), hete elektronen worden overgebracht naar H2-moleculen en zorgen ervoor dat ze dissociëren. Aangezien dissociatie de snelheidsbeperkende stap is in veel chemische reacties, dit hete elektronenproces kan de reactie-efficiëntie verhogen. Afbeelding tegoed:Shaunak Mukherjee, et al. ©2012 American Chemical Society
(Phys.org)—Van aardolieraffinage tot voedselverwerking, de overgrote meerderheid van commerciële chemische toepassingen omvat katalysatoren om de snelheid van chemische reacties te regelen. Alles wat de efficiëntie van katalysatoren kan verhogen, kan een wijdverbreide impact hebben op deze gebieden. In een nieuwe studie, wetenschappers hebben aangetoond dat een efficiëntieverbetering mogelijk is door "hete" elektronen (die met een zeer hoge energie) te creëren uit een metalen oppervlak waarop de chemische reactie plaatsvindt, en het gebruik van de elektronen om de chemische reactie te beheersen en efficiënter te maken.
De onderzoekers, onder leiding van professoren Peter Nordlander en Naomi J. Halas van Rice University in Houston, Texas, en professor Emily A. Carter van Princeton University, New Jersey, hebben hun studie over de techniek om de katalytische chemie te verbeteren gepubliceerd in een recent nummer van Nano-letters .
In hun methode de onderzoekers gebruikten een laser met zichtbaar licht om een gouden nanodeeltjesoppervlak (het katalysatoroppervlak) bij kamertemperatuur te verlichten. Het binnenkomende laserlicht prikkelt optisch oppervlakteplasmonen op het metalen oppervlak, en de plasmonen vervallen dan in hete elektronen. Vanwege hun hoge energie, de hete elektronen strekken zich verder van de nanodeeltjes uit dan elektronen met lagere energieën. Als er een ander atoom of molecuul in de buurt is dat het elektron kan opnemen, het hete elektron kan overgaan in de elektronische toestanden van die acceptor.
Bij deze experimenten de onderzoekers adsorbeerden H 2 moleculen op het gouden nanodeeltjesoppervlak, een procedure die vaak wordt uitgevoerd in heterogene katalyse, waarin de geadsorbeerde moleculen fungeren als reactanten. De onderzoekers vonden, als het belangrijkste resultaat van hun onderzoek, dat sommige van de hete elektronen zouden kunnen overgaan in de gesloten schillen van de H 2 moleculen en ervoor zorgen dat de twee waterstofatomen scheiden, of dissociëren. Dit proces, genaamd "plasmon-geïnduceerde dissociatie van H 2 op Au, " zou de efficiëntie van bepaalde chemische reacties kunnen verbeteren.
"Bij veel belangrijke chemische reacties, de snelheidsbeperkende stap is de dissociatie van gesloten omhulselmoleculen zoals een waterstofmolecuul, "Nordlander vertelde" Phys.org . "Als deze reactiestap kan worden 'afhandeld' (met behulp van ons aangetoonde hete elektronenproces), de reactie kan veel sneller verlopen en minder energie vereisen."
Om de dissociatie te meten, de onderzoekers stelden het nanodeeltjessubstraat bloot aan zowel H 2 en D 2 (twee atomen deuterium, een waterstofisotoop met één neutron). Als de hete elektronen deze moleculen zouden dissociëren, het zou resulteren in de vorming van ZvH-moleculen. De onderzoekers vonden dat, zodra ze de laser aanzetten, de snelheid van HD-vorming op het oppervlak van nanodeeltjes nam met een factor 6 toe. Ze maten ook dat de snelheid sterk afhankelijk was van de concentratie en grootte van de gouden nanodeeltjes. De onderzoekers legden uit dat, in zekere zin, de elektronen "doen het onmogelijke" omdat er zonder hen geen dissociatie zou zijn.
"Een waterstofmolecuul geadsorbeerd op een macroscopisch goudoppervlak dissocieert niet spontaan, zelfs bij hoge temperaturen, " zei Nordlander. "Het is een onmogelijke chemische reactie. De energie voor dissociatie is simpelweg te groot. We hebben precies om deze reden gekozen voor het waterstof-goudsysteem. We wilden een systeem waarbij de interpretatie van het effect eenvoudig was. Op andere metalen, zoals overgangsmetalen, een waterstofmolecuul kan spontaan dissociëren, in het bijzonder in de buurt van defecten en bij verhoogde temperaturen. Maar niet op goud."
Deze resultaten laten zien hoe het veld van plasmonica - waarbij interacties tussen fotonen en nanostructuren betrokken zijn - toepassingen kan hebben op het gebied van katalytische chemie, in het bijzonder fotokatalyse, De onderzoekers hopen dat deze demonstratie van het vermogen om chemische reacties met behulp van licht te beheersen, kan worden uitgebreid voor specifieke toepassingen. Door de laserfrequentie te gebruiken om de oppervlakteplasmonresonanties af te stemmen, het kan mogelijk zijn om hete elektronen te creëren met specifieke energieën die specifieke elektronische toestanden van moleculen bevolken die op het oppervlak van nanodeeltjes zijn geadsorbeerd.
"De onmiddellijke toepassing is om de efficiëntie van metallische katalysatoren te verbeteren door ze te verlichten met licht, " zei Nordlander. "Onze groepen hebben een zeer 'groene agenda' en het is onze bedoeling om nieuwe soorten katalysatoren te ontwerpen die worden aangedreven door zonlicht. Dit is iets wat we hier in Houston in overvloed hebben.
"Een andere belangrijke toepassing is om te onderzoeken in hoeverre we chemische reacties kunnen sturen en beheersen door hete elektronen van bepaalde energieën over te laten gaan naar specifieke moleculaire orbitalen. Dit is een relatief onontgonnen onderzoeksonderwerp. Normale elektronen hebben positieve energieën en zijn veel 'heter' dan onze hete elektronen. Dergelijke hoogenergetische elektronen blijven doorgaans niet lang genoeg op een molecuul om de atomen te laten bewegen."
Copyright 2012 Phys.org
Alle rechten voorbehouden. Dit materiaal mag niet worden gepubliceerd, uitzending, geheel of gedeeltelijk herschreven of herverdeeld zonder de uitdrukkelijke schriftelijke toestemming van Phys.org.
 Een elektrisch geladen glazen display wisselt soepel tussen een spectrum van kleuren
Een elektrisch geladen glazen display wisselt soepel tussen een spectrum van kleuren Duurzame 3D-geprinte supermagneten
Duurzame 3D-geprinte supermagneten Chemische katalysator verandert afval in schat, inerte C-H-bindingen reactief maken
Chemische katalysator verandert afval in schat, inerte C-H-bindingen reactief maken Hoe te veel koeling voor een koeltoren te berekenen
Hoe te veel koeling voor een koeltoren te berekenen Nieuwe theorieën en materialen helpen de overgang naar schone energie
Nieuwe theorieën en materialen helpen de overgang naar schone energie
 Wolverine Animal Facts
Wolverine Animal Facts NASA ziet tropische cycloon Alcide orkaansterkte bereiken
NASA ziet tropische cycloon Alcide orkaansterkte bereiken Op het land gebaseerde microben kunnen koraalriffen binnendringen en schaden
Op het land gebaseerde microben kunnen koraalriffen binnendringen en schaden Wetenschappers voeren eerste in situ stralingsmetingen uit op 21 km in de lucht boven het Tibetaanse plateau
Wetenschappers voeren eerste in situ stralingsmetingen uit op 21 km in de lucht boven het Tibetaanse plateau Houston, waren hier om de boeren te helpen
Houston, waren hier om de boeren te helpen
Hoofdlijnen
- Wetenschappers identificeren het verband tussen licht en chloroplastontwikkeling
- Wat maakt bodem, bodem? Onderzoekers vinden verborgen aanwijzingen in DNA
- Waar worden mensen blij van?
- Waarom is UV-licht schadelijk?
- Kun je later in je leven ambidexter worden? Het hangt er van af
- Wat zijn de zes belangrijkste elementen in levende organismen?
- Mummies buikjes om de evolutie van de spijsvertering te onthullen
- Moleculaire genetica (biologie): een overzicht
- Chromosoomorganisatie komt voort uit 1-D-patronen
- Stabiliserende liganden maken nanoclusters helderder
- Doorbraak in de nanowetenschap:deeltjes kleiner dan een miljardste meter onderzoeken
- Nieuwe draagbare sensor volgt vitamine C-niveaus in zweet

- Enkellaags en dubbellaags grafeen verfraaien met nuttige chemische groepen
- Veelbelovende nieuwe aanpak voor gecontroleerde fabricage van koolstofnanostructuren

 Schud die vleugels
Schud die vleugels Project om gedetailleerde gegevens over microplastics te verzamelen begint met expeditie naar de Stille Oceaan
Project om gedetailleerde gegevens over microplastics te verzamelen begint met expeditie naar de Stille Oceaan Een laserstraal maken
Een laserstraal maken  Kaspersky op de zwarte lijst getipt NSA over inbreuk op de beveiliging:media
Kaspersky op de zwarte lijst getipt NSA over inbreuk op de beveiliging:media OPERA-samenwerking presenteert haar eindresultaten over neutrino-oscillaties
OPERA-samenwerking presenteert haar eindresultaten over neutrino-oscillaties Afbeelding:Californië in brand
Afbeelding:Californië in brand Biologisch afbreekbare bruggen:levende structuren die reageren op de omgeving
Biologisch afbreekbare bruggen:levende structuren die reageren op de omgeving Realtime monitoringtool versnelt de ontwikkeling van geavanceerde kernreactoren
Realtime monitoringtool versnelt de ontwikkeling van geavanceerde kernreactoren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Swedish | Norway |

-
Wetenschap © https://nl.scienceaq.com

