
Wetenschap
Wetenschappers gebruiken plasmonische nanobellen in levende organismen om te detecteren, elimineren prostaatkankercellen (met video)
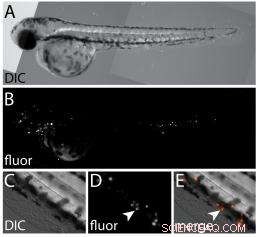
Een reeks afbeeldingen toont:A) een differentieel interferentiecontrast (DIC) witlichtbeeld van zebravisembryo gelabeld met fluorescerende menselijke prostaatkankercellen; B) een fluorescerend beeld van het embryo in A, het onthullen van de gexenografeerde kankercellen; C) een DIC-beeld met hoge vergroting van de ventrale staartvin; D) een fluorescerend beeld van hetzelfde gebied in C dat xenografted cellen onthult (pijlpunt); en E) een samengevoegde afbeelding van C en D. (Credit:Wagner Lab/Rice University)
(PhysOrg.com) -- Natuurkundige Dmitri Lapotko van Rice University heeft aangetoond dat plasmonische nanobellen, gegenereerd rond gouden nanodeeltjes met een laserpuls, kan kankercellen detecteren en vernietigen in vivo door kleine, glanzende dampbellen die de cellen onthullen en selectief exploderen.
Een paper in de oktober-editie van het tijdschrift Biomaterialen beschrijft het effect van plasmonische nanobellen-theranostica op zebravissen geïmplanteerd met levende menselijke prostaatkankercellen, het aantonen van de geleide ablatie van kankercellen in een levend organisme zonder de gastheer te beschadigen.
Lapotko en zijn collega's ontwikkelden het concept van celtherapie om drie belangrijke behandelingsfasen te verenigen:diagnose, therapie en bevestiging van de therapeutische actie -- in één samenhangende procedure. De unieke afstembaarheid van plasmonische nanobellen maakt de procedure mogelijk. Hun diermodel, de zebravis, is bijna transparant, wat het ideaal maakt voor dergelijk in vivo onderzoek.
De National Institutes of Health hebben het potentieel van Lapotko's geïnspireerde techniek erkend door verder onderzoek te financieren dat een enorm potentieel biedt voor de theranostica van kanker en andere ziekten op cellulair niveau. Lapotko's plasmonisch nanobellenlab, een gezamenlijk Amerikaans-Wit-Russisch laboratorium voor fundamentele en biomedische nanofotonica, heeft de komende vier jaar een subsidie van meer dan $ 1 miljoen ontvangen om de techniek verder te ontwikkelen.
In eerder onderzoek in Lapotko's thuislab in de National Academy of Sciences van Wit-Rusland, plasmonische nanobellen toonden hun theranostische potentieel aan. In een ander onderzoek naar cardiovasculaire toepassingen, nanobellen werden gefilmd terwijl ze zich een weg baanden door arteriële plaque. Hoe sterker de laserpuls, hoe schadelijker de explosie wanneer de bellen barsten, waardoor de techniek zeer afstembaar is. De bellen variëren in grootte van 50 nanometer tot meer dan 10 micrometer.
In de zebravisstudie, Lapotko en zijn medewerkers bij Rice leidden met antilichaam gemerkte gouden nanodeeltjes in de geïmplanteerde kankercellen. Een korte laserpuls oververhitte het oppervlak van de nanodeeltjes en verdampte een zeer dun volume van het omringende medium om kleine dampbellen te creëren die binnen nanoseconden uitzetten en instortten; hierdoor bleven de cellen onbeschadigd maar genereerde een sterk optisch verstrooiingssignaal dat helder genoeg was om een enkele kankercel te detecteren.
Een seconde, sterkere puls genereerde grotere nanobellen die explodeerden (of, zoals de onderzoekers het noemden, "mechanisch geablateerd") de doelcel zonder het omliggende weefsel in de zebravis te beschadigen. Verstrooiing van het laserlicht door de tweede "killer"-bel bevestigde de cellulaire vernietiging.
Dat het proces mechanisch van aard is, staat centraal, zei Lapotko. De nanobellen vermijden de valkuilen van chemo- of bestralingstherapie die zowel gezond weefsel als tumoren kunnen beschadigen.
"Het is geen deeltje dat de kankercel doodt, maar een voorbijgaande en korte gebeurtenis, " zei hij. "We zetten lichtenergie om in mechanische energie."
De nieuwe subsidie stelt Lapotko en zijn medewerkers in staat om de biologische effecten van plasmonische nanobellen te bestuderen en vervolgens hun functies te combineren in een enkele sequentie die slechts een microseconde zou kosten om een kankercel te detecteren en te vernietigen en de resultaten te bevestigen. "Door hun grootte dynamisch af te stemmen, we zullen hun biologische werking afstemmen van niet-invasieve detectie tot gelokaliseerde intracellulaire medicijnafgifte tot selectieve eliminatie van specifieke cellen, " hij zei.
"Een stealth zijn, on-demand sonde met afstembare functie, de plasmonische nanobubbel kan op alle gebieden van de geneeskunde worden toegepast, aangezien het nanobellenmechanisme universeel is en kan worden gebruikt voor het detecteren en manipuleren van specifieke moleculen, of voor precieze microchirurgie."
Lapotko's co-auteurs over de Biomaterialen papier zijn Daniel Wagner, universitair docent biochemie en celbiologie; Mary "Cindy" Farach-Carson, associate vice-provoost voor onderzoek en hoogleraar biochemie en celbiologie; Jason Hafner, universitair hoofddocent natuur- en sterrenkunde en scheikunde; Nikki Delk, postdoctoraal onderzoeksmedewerker; en Ekaterina Lukianova-Hleb, onderzoeker in het Plasmonic Nanobubble Lab.
 Waarom is ontbossing een ernstig wereldwijd milieuprobleem?
Waarom is ontbossing een ernstig wereldwijd milieuprobleem?  Oude kleren veranderen in hoogwaardige bouwmaterialen
Oude kleren veranderen in hoogwaardige bouwmaterialen Geïrrigeerde landbouw in het centrale zand van Wisconsin koelt het klimaat van de regio af
Geïrrigeerde landbouw in het centrale zand van Wisconsin koelt het klimaat van de regio af Natuurlijk gas, valse hoop in campagne tegen klimaatverandering?
Natuurlijk gas, valse hoop in campagne tegen klimaatverandering? Stof heeft duizenden kilometers afgelegd om de Hawaiiaanse bodem te verrijken
Stof heeft duizenden kilometers afgelegd om de Hawaiiaanse bodem te verrijken
Hoofdlijnen
- Nieuwe statistische methode voor het evalueren van reproduceerbaarheid in studies van genoomorganisatie
- Met uitsterven bedreigde mus in Centraal-Florida die in het wild waarschijnlijk niet zal overleven
- Wat is de functie van tracking-kleurstof in gelelektroforese?
- Waarom zingen mensen onder de douche?
- Middeleeuwse kist levert fascinerend skelet op
- Virusstamping - een veelzijdige nieuwe methode voor genetische manipulatie van afzonderlijke cellen
- Wat zijn drie dingen die bepalen of een molecuul in een celmembraan kan diffunderen?
- Wat gebeurt er als je een lijk ontdooit?
- Haploid versus diploïde: wat zijn de overeenkomsten & verschillen?
- Bio meets nano:Quantum dots als lichtantennes voor kunstmatige fotosynthetische systemen
- Onderzoekers bereiken RNA-interferentie, in een lichtere verpakking

- Wetenschappers leggen uit hoe cijfergegevens kunnen worden opgeslagen in magnetische skyrmionen
- Ontdekking kan leiden tot munitie die verder gaat, veel sneller

- Wetenschappers gebruiken DNA-origami-truc om 2D-structuren te maken

 Emissie vluchtige organische stoffen hoger dan eerder aangenomen
Emissie vluchtige organische stoffen hoger dan eerder aangenomen Ericsson slaat mobiele beurs over vanwege coronavirus
Ericsson slaat mobiele beurs over vanwege coronavirus Unieke chemie - die ooit zou kunnen helpen bij het bestrijden van ernstige ziekten - gevonden in de Nieuw-Zeelandse glimworm
Unieke chemie - die ooit zou kunnen helpen bij het bestrijden van ernstige ziekten - gevonden in de Nieuw-Zeelandse glimworm Ryanair sluit deal met Duitse vakbond voor cabinepersoneel
Ryanair sluit deal met Duitse vakbond voor cabinepersoneel Voorbij de singulariteit van het zwarte gat
Voorbij de singulariteit van het zwarte gat Hoe saffieren worden gevormd
Hoe saffieren worden gevormd  Hoe beoefenen Amerikanen religie tijdens de pandemie?
Hoe beoefenen Amerikanen religie tijdens de pandemie? Focus op de chemie van nucleair afval kan helpen bij de uitdagingen van de federale opruimsite
Focus op de chemie van nucleair afval kan helpen bij de uitdagingen van de federale opruimsite
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

