
Wetenschap
Hoe bewegen elektronen in een atoom?
1. Elektronenorbitalen:
* Geen banen: Elektronen draaien niet om de kern in nette cirkels of ellipsen zoals planeten. In plaats daarvan bestaan ze in regio's van de ruimte genaamd orbitalen .
* Vorm en energie: Orbitalen hebben specifieke vormen (zoals bollen, halters, enz.) En energieniveaus. De vorm van een orbitaal bepaalt waar een elektron waarschijnlijk wordt gevonden.
* waarschijnlijkheid, niet zekerheid: De locatie van het elektron binnen een orbitaal wordt beschreven door een waarschijnlijkheidsverdeling. Dit betekent dat we alleen kunnen praten over de kans op het vinden van een elektron op een bepaalde plek, niet de exacte positie.
2. Kwantumnummers:
* Elektronen beschrijven: Elektronen in atomen worden beschreven door een set van vier kwantumnummers:
* Hoofdkwantumnummer (n): Bepaalt het energieniveau van de elektron. Hogere 'n' -waarden betekenen hogere energie.
* Angular Momentum Quantum Number (L): Beschrijft de vorm van de orbitale (s, p, d, f).
* magnetisch kwantumnummer (ml): Specificeert de oriëntatie van het orbitaal in de ruimte.
* Spin Quantum Number (MS): Vertegenwoordigt het intrinsieke hoekmomentum van het elektron, dat wordt gekwantiseerd en werkt als een kleine magnetische dipool.
3. Elektronenovergangen:
* Energie verandert: Elektronen kunnen energie absorberen of vrijgeven, waardoor ze tussen verschillende energieniveaus (orbitalen) springen.
* absorptie: Wanneer een elektron energie absorbeert, gaat het naar een hoger energieniveau.
* emissie: Wanneer een elektron energie verliest, valt het naar een lager energieniveau en laat de energie als licht vrij.
4. Het onzekerheidsprincipe:
* Positie en momentum: Het Heisenberg -onzekerheidsprincipe stelt dat we zowel de positie als het momentum van een elektron met perfecte nauwkeurigheid tegelijkertijd niet kunnen kennen.
* implicaties: Dit betekent dat het onmogelijk is om het exacte pad van een elektron te voorspellen, alleen de kans om het in een bepaald gebied te vinden.
Samenvattend:
Elektronen in atomen volgen geen eenvoudige paden. Hun gedrag wordt bepaald door de kwantummechanica en we kunnen hun locaties en energieën alleen beschrijven in termen van waarschijnlijkheden. Het concept van orbitalen helpt ons de ruimte te begrijpen waar elektronen het meest waarschijnlijk worden gevonden.
 Wat is de ecologische voetafdruk van het bezitten van vis als huisdier? Een deskundige legt het uit
Wat is de ecologische voetafdruk van het bezitten van vis als huisdier? Een deskundige legt het uit  De praktische drive voor duurzaam leven in Europa
De praktische drive voor duurzaam leven in Europa  Sneeuw- en zanderosie uitgelegd
Sneeuw- en zanderosie uitgelegd Braziliaanse rechtbank blokkeert verhuizing om mangrovebescherming in te trekken
Braziliaanse rechtbank blokkeert verhuizing om mangrovebescherming in te trekken Dode zones in het meer kunnen vissen doden en drinkwater vergiftigen
Dode zones in het meer kunnen vissen doden en drinkwater vergiftigen
Hoofdlijnen
- Wat is het proces waarmee cellen energie in voedsel vrijgeven om processen voort te zetten?
- De aandelen van Apple verzuren, die van Microsoft stijgen. Zeg wat?!
- Hoe zouden vacuolen in planten dienen als verdediging tegen die opeten?
- Biomassa versus energiepiramides
- Wie heeft de classificatie van dieren uitgevonden?
- Apple-CEO Tim Cook legt uit waarom hij zich uitsprak over immigratie
- Waarom is chemie belangrijk voor de studie van anatomie en fysiologie?
- Wat is de rol van enzymcomplex in de elektrontransportketen?
- Honden snuffelden vroeger aan zeldzame soorten
- Hoofdschudden om water in de oren kwijt te raken kan hersenbeschadiging veroorzaken, natuurkundigen vinden
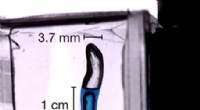
- Het vinden van orde in wanorde toont een nieuwe staat van materie aan

- De voortgang van fusie-energie volgen door 60 jaar neutrale deeltjesanalyse

- Wetenschappers bedenken een manier om mysterieus donkere werelddeeltje te vangen bij Large Hadron Collider
- Wolfraamisotoop helpt bij het bestuderen van toekomstige fusiereactoren

 Is het waar dat een lichaam met nulversnelling geen potentiële energie kan hebben?
Is het waar dat een lichaam met nulversnelling geen potentiële energie kan hebben?  Nanodeeltjesscherm kan de ontwikkeling van geneesmiddelen versnellen
Nanodeeltjesscherm kan de ontwikkeling van geneesmiddelen versnellen Hoe kan energie van plaats naar plaats worden overgedragen?
Hoe kan energie van plaats naar plaats worden overgedragen?  Welke regio van de zon heeft een temperatuur van ongeveer 15 miljoen ° C?
Welke regio van de zon heeft een temperatuur van ongeveer 15 miljoen ° C?  Hoeveel warmte in KCAL moet worden toegevoegd aan 5,0 kg water bij kamertemperatuur 20C zijn 44C verhoogt?
Hoeveel warmte in KCAL moet worden toegevoegd aan 5,0 kg water bij kamertemperatuur 20C zijn 44C verhoogt?  De willekeurige diffusie van ontbrekende atomen in grafeen observeren
De willekeurige diffusie van ontbrekende atomen in grafeen observeren Namen van instrumenten voor het meten van hoeken
Namen van instrumenten voor het meten van hoeken Studie:Prehistorische paarden waren huislichamen
Studie:Prehistorische paarden waren huislichamen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

