
Wetenschap
Hoe laat de overgang zien dat de positie van elektron wordt gekwantiseerd?
1. Energieniveaus worden gekwantiseerd:
* Elektronen in een atoom kunnen alleen bestaan in specifieke, afzonderlijke energieniveaus. Deze niveaus zijn gekwantiseerd, wat betekent dat ze alleen bepaalde vaste waarden kunnen aannemen.
* Elk energieniveau komt overeen met een specifiek orbitaal, dat de kans definieert om het elektron in een bepaald gebiedsgebied te vinden.
2. Overgangen en energie -absorptie/emissie:
* Wanneer een elektron energie absorbeert (bijvoorbeeld van licht), kan het naar een hoger energieniveau springen.
* Wanneer een elektron daalt van een hoger energieniveau naar een lagere, brengt het het energieverschil in de vorm van een foton van licht af.
3. De link naar kwantisatie:
* De energie van het foton dat tijdens een overgang wordt uitgezonden of geabsorbeerd, is precies gelijk aan het energieverschil tussen de twee betrokken energieniveaus.
* Omdat alleen specifieke energieniveaus zijn toegestaan, zijn de energieverschillen ertussen ook discreet en gekwantiseerd.
* Dit betekent dat de uitgezonden of geabsorbeerde fotonen alleen specifieke, gekwantiseerde frequenties (en dus golflengten) hebben, overeenkomend met de verschillen in energieniveau.
4. Spectroscopisch bewijs:
* Spectroscopische waarnemingen bevestigen deze kwantisatie:wanneer licht van atomen door een prisma wordt geleid, splitst het zich in een discreet spectrum van lijnen, in plaats van een continu spectrum.
* De golflengtes van deze lijnen komen precies overeen met de energieverschillen tussen de toegestane energieniveaus in de atomen, waardoor sterk bewijs wordt geleverd voor de kwantisatie van elektronenergieniveaus.
5. Kwantificering van positie:
* Hoewel we de exacte positie van een elektron op een bepaald moment niet kunnen bepalen, wordt de kans om het in een bepaald gebiedsgebied te vinden bepaald door zijn orbitaal.
* Elk orbitaal komt overeen met een specifiek energieniveau en de overgang van een elektron tussen orbitalen is een direct gevolg van de kwantisatie van zijn energie.
* Daarom suggereren de waargenomen overgangen tussen gekwantiseerde energieniveaus, gemanifesteerd in de emissie- en absorptiespectra, sterk dat de positie van het elektron ook wordt gekwantiseerd.
Samenvattend:
De kwantisatie van elektronenenergieniveaus, blijkt uit de afzonderlijke spectrale lijnen waargenomen bij atomaire emissie en absorptie, impliceert de kwantisatie van elektronenposities, aangezien de toegestane energieniveaus overeenkomen met specifieke, gekwantiseerde orbitalen. Dit is een centraal principe van kwantummechanica en een fundamenteel aspect van ons begrip van atomaire structuur.
 Wat is het effect van temperatuurverandering tot hoeveelheid warmte -inhoud van de inhoud?
Wat is het effect van temperatuurverandering tot hoeveelheid warmte -inhoud van de inhoud?  De oorsprong van smaakafwijkingen in uien
De oorsprong van smaakafwijkingen in uien Waarom de thermische stabiliteit van alkali -metaalhydride de groep afneemt?
Waarom de thermische stabiliteit van alkali -metaalhydride de groep afneemt?  Een nieuwe manier om ijsafzetting te verwijderen zonder stroom of chemicaliën
Een nieuwe manier om ijsafzetting te verwijderen zonder stroom of chemicaliën Is het waar dat subscripts kunnen worden gewijzigd om een chemische vergelijking in evenwicht te brengen?
Is het waar dat subscripts kunnen worden gewijzigd om een chemische vergelijking in evenwicht te brengen?
 We hebben helemaal verkeerd nagedacht over hoe ijs zich vormt in cirruswolken
We hebben helemaal verkeerd nagedacht over hoe ijs zich vormt in cirruswolken Boeren gebruiken technologie om elke druppel uit de Colorado-rivier te persen
Boeren gebruiken technologie om elke druppel uit de Colorado-rivier te persen Klimaatcrisis kan frequentie van extreme regionale zomerdroogten in Europa verdubbelen
Klimaatcrisis kan frequentie van extreme regionale zomerdroogten in Europa verdubbelen Wat gebeurt er met luchtdruk als je van de troposfeer naar de thermosfeer beweegt?
Wat gebeurt er met luchtdruk als je van de troposfeer naar de thermosfeer beweegt?  Wat veroorzaakte de ijstijden? Kleine oceaanfossielen bieden belangrijk bewijs
Wat veroorzaakte de ijstijden? Kleine oceaanfossielen bieden belangrijk bewijs
Hoofdlijnen
- Zijn DNA -fragmenten uit twee verschillende organismen samengevoegd om een genoom te vormen?
- Uit onderzoek blijkt dat klimaatverandering tropische vissen helpt het Australische oceaanwater binnen te dringen
- Wat doet de kern tot lipiden?
- Welke processen worden gebruikt door wetenschapper die veldstudies maakt en degenen die vervalsen doen?
- Wat bepaalt de samenstelling van microben in de darmen van een grasmus?
- Waarom wordt penicillium geclassificeerd als deuteromycota?
- De belangrijkste functie van witte bloedcellen is?
- Wat staat de wetenschap van taxonomie toe dat wetenschappers doen?
- Biologen ontdekken tastzin van bacteriën
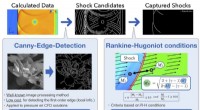
- Onderzoekers ontwikkelen een uniforme sensor om de effecten van schokgolven beter te beheersen
- Neutrino-experimenten lijken grote antwoorden te onthullen over hoe deze fundamentele deeltjes interageren met materie

- Een nieuwe draai aan kwantumcommunicatie in glasvezel
- Natuurkundigen ontwikkelen een apparaat dat afdoend bewijs kan leveren voor het bestaan (of niet) van niet-Abelse anyons

- Energiecascades in quasikristallen veroorzaken een lawine van ontdekkingen

 Gezondheidswaarschuwingen afgegeven omdat rook van Bobcat-brand de luchtkwaliteit in L.A. verstikt
Gezondheidswaarschuwingen afgegeven omdat rook van Bobcat-brand de luchtkwaliteit in L.A. verstikt Wat gebeurt er met zijn snelheid bij het gooien van een munt naar boven tijdens het stijgen van versnelling?
Wat gebeurt er met zijn snelheid bij het gooien van een munt naar boven tijdens het stijgen van versnelling?  Hoe evolutie de wetenschap ten goede kan veranderen
Hoe evolutie de wetenschap ten goede kan veranderen Wat zet chemische energie om in elektrische energie?
Wat zet chemische energie om in elektrische energie?  Californië klaagt aan wegens plan om emissienormen voor auto's te schrappen
Californië klaagt aan wegens plan om emissienormen voor auto's te schrappen Een nogal inactief gas dat dit lid van de koninklijke familie bijna 1 van onze atmosfeer uitmaakt?
Een nogal inactief gas dat dit lid van de koninklijke familie bijna 1 van onze atmosfeer uitmaakt?  Waarom 'Coach' meestal een kerel is
Waarom 'Coach' meestal een kerel is  Hoe zou het een zwaartekracht tussen twee objecten beïnvloeden als het verder uit elkaar wordt verplaatst?
Hoe zou het een zwaartekracht tussen twee objecten beïnvloeden als het verder uit elkaar wordt verplaatst?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

