
Wetenschap
Waarom kunnen wetenschappers de aantrekkingskrachten tussen deeltjes negeren in een gas onder gewone omstandigheden?
Hier is een uitsplitsing:
* Kinetische energie: Gasdeeltjes zijn in constante, willekeurige beweging. Deze beweging geeft hen kinetische energie, die evenredig is met hun temperatuur. Hoe hoger de temperatuur, hoe sneller de deeltjes bewegen en hoe groter hun kinetische energie.
* intermoleculaire krachten: Dit zijn de aantrekkelijke krachten tussen moleculen. In gassen zijn deze krachten relatief zwak, voornamelijk te wijten aan de grote afstanden tussen moleculen. Zie het zo:de moleculen stuiteren zo snel rond en zijn zo ver uit elkaar dat ze niet veel tijd hebben om elkaars aantrekkingskracht te "voelen".
De ideale gaswet
Dit concept is van fundamenteel belang voor de ideale gaswet, die het gedrag van gassen onder ideale omstandigheden beschrijft:
* pv =nrt
* P =druk
* V =volume
* n =aantal mol
* R =ideale gasconstante
* T =temperatuur
De ideale gaswet gaat ervan uit dat gasdeeltjes geen volume hebben en geen intermoleculaire krachten. Hoewel dit in werkelijkheid niet strikt waar is, is het een goede benadering voor veel gassen onder gewone omstandigheden.
Wanneer krachten ertoe doen
Hoewel intermoleculaire krachten vaak kunnen worden genegeerd, zijn er situaties waarin ze belangrijker worden:
* Hoge druk: Wanneer de druk toeneemt, worden de moleculen dichter bij elkaar geperst, waardoor de invloed van intermoleculaire krachten wordt vergroot.
* lage temperatuur: Bij lage temperaturen hebben de moleculen minder kinetische energie, waardoor intermoleculaire krachten invloedrijker worden.
* Polaire gassen: Gassen met polaire moleculen (moleculen met ongelijke ladingsverdeling) hebben sterkere intermoleculaire krachten dan niet -polaire gassen.
Samenvattend: Wetenschappers kunnen intermoleculaire krachten in gassen vaak negeren omdat ze zwak zijn in vergelijking met de kinetische energie van de deeltjes. In bepaalde omstandigheden kunnen deze krachten echter belangrijker worden en moeten rekening worden gehouden.
 Waar is levende materie van gemaakt?
Waar is levende materie van gemaakt?  Hebben alle planten dezelfde voorwaarden nodig om goed te groeien?
Hebben alle planten dezelfde voorwaarden nodig om goed te groeien?  Geofysicus blijft ondanks enorm gat optimistisch over Arctische ozonlaag
Geofysicus blijft ondanks enorm gat optimistisch over Arctische ozonlaag Onthullend hoe vliegen tijdens de vlucht beslissingen nemen om te overleven
Onthullend hoe vliegen tijdens de vlucht beslissingen nemen om te overleven  Hoe materie en wetenschappelijke methode helpen bij de mens?
Hoe materie en wetenschappelijke methode helpen bij de mens?
Hoofdlijnen
- Wat gebeurt er met de vorm en functie van een eiwit als één aminozuren worden vervangen door ander type zuur?
- Dieren zijn geëvolueerd om overexploitatie van hun hulpbronnen te voorkomen. Kunnen mensen hetzelfde doen?
- Wat is het verschil tussen een prokaryotische en eukaryotische cel?
- Hoe de tijd het lot van stamcellen beïnvloedt
- Cellulaire ademhaling in planten
- Indringende vraag:Wat is een neutrino?
- De vreemde empathie van plaatsvervangende schaamte
- Waarom hebben dierencellen het meest direct zuurstof nodig?
- Met welke organel zijn eiwitten gesynthetiseerd?
- Sterren als generatoren van willekeurige getallen kunnen de fundamenten van de natuurkunde testen
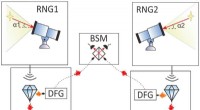
- Een gigantisch magnetisch veld realiseren door moiré-patroontechniek
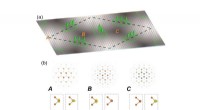
- Onderzoekers ontwikkelen nieuwe theoretische benadering om licht te manipuleren

- Onderzoekers generaliseren de 200 jaar oude warmtevergelijking van Fouriers, hydrodynamische warmtevoortplanting uitleggen

- Nieuwe kwantumrepeater maakt de weg vrij voor grote datatransmissie over grote afstanden

 Wat is de beste definitie voor de maat voor een fotonenergie?
Wat is de beste definitie voor de maat voor een fotonenergie?  De entropie van naties:de mondiale energie-ongelijkheid neemt af, maar voor hoe lang?
De entropie van naties:de mondiale energie-ongelijkheid neemt af, maar voor hoe lang?  Hoe wordt natriumsulfide geproduceerd?
Hoe wordt natriumsulfide geproduceerd?  Het personeelsverloop is een probleem. Hier leest u hoe u dit kunt oplossen
Het personeelsverloop is een probleem. Hier leest u hoe u dit kunt oplossen  Hoe ver zou het voor jou zijn om vanuit de aarde de zon en dan Venus te reizen?
Hoe ver zou het voor jou zijn om vanuit de aarde de zon en dan Venus te reizen?  De natuur moet centraal staan in de economie, zeggen onderzoekers
De natuur moet centraal staan in de economie, zeggen onderzoekers Welk type energie in stromend water?
Welk type energie in stromend water?  Hoe wordt het genoemd wanneer kracht en beweging in de richting zijn?
Hoe wordt het genoemd wanneer kracht en beweging in de richting zijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

