
Wetenschap
Waarom verliest een element 4S -elektronen vóór 3D -elektronen?
energieniveaus en afscherming:
* energieniveaus: De 4s orbital is eigenlijk * lager in energie * dan de 3D orbital. Dit lijkt misschien contra -intuïtief, maar het is te wijten aan het feit dat de 4s orbitaal dichter bij de kern doordringt, minder afscherming van binnenste elektronen ervaart en een sterkere aantrekkingskracht voelt.
* Afscherming: De 3D -elektronen ervaren een grotere afscherming van de binnenste elektronen en duwen ze naar een iets hoger energieniveau.
ionisatie en stabiliteit:
* gemakkelijker verwijdering: Omdat de 4S -elektronen zich op een lager energieniveau bevinden, zijn ze gemakkelijker te verwijderen tijdens ionisatie. Er is minder energie voor nodig om een 4S -elektron te verwijderen dan een 3D -elektron.
* Stabiliteit van elektronenconfiguratie: Na het verliezen van de 4S-elektronen heeft het resulterende ion vaak een stabiele elektronenconfiguratie, met een volledige of halfvolle D-subshell, die stabieler is dan een gedeeltelijk gevulde D-subshell.
Voorbeeld:overgangsmetalen
Laten we het voorbeeld van ijzer (FE) nemen:
* grondtoestand: Fe:[AR] 4S² 3D⁶
* Eerste ionisatie: Fe⁺:[AR] 4S¹ 3D⁶
* Tweede ionisatie: Fe²⁺:[AR] 3D⁶
Merk op hoe het 4S -elektron eerst verloren gaat, hoewel het 3D -orbitaal hoger in energie is. Dit komt omdat het resulterende Fe²⁺-ion een stabielere elektronenconfiguratie heeft met een halfvolle 3D-subshell.
Belangrijke punten om te onthouden:
* Energieniveaus komen niet altijd overeen met het belangrijkste kwantumnummer (N).
* Afschermingseffecten spelen een cruciale rol bij het bepalen van elektronenenergieën.
* Ionisatie wordt aangedreven door de zoektocht naar een stabiele elektronenconfiguratie.
Laat het me weten als je nog andere vragen hebt over elektronenconfiguratie of ionisatie!
 Wetenschappers passen vingerafdruktest toe voor CO2-opslag
Wetenschappers passen vingerafdruktest toe voor CO2-opslag Een perfecte storm:beoordeling van de dodelijke impact van klimaatgerelateerde overstromingen en cyberaanvallen
Een perfecte storm:beoordeling van de dodelijke impact van klimaatgerelateerde overstromingen en cyberaanvallen  Geef voorbeelden van verschillende manieren waarop observaties wetenschappelijk onderzoek worden gebruikt?
Geef voorbeelden van verschillende manieren waarop observaties wetenschappelijk onderzoek worden gebruikt?  NASA vangt de vorming en het uiteindelijke lot van de tropische depressie van de oostelijke Stille Oceaan 1E
NASA vangt de vorming en het uiteindelijke lot van de tropische depressie van de oostelijke Stille Oceaan 1E Welke kenmerken scheiden niet -levende wezens van dingen?
Welke kenmerken scheiden niet -levende wezens van dingen?
Hoofdlijnen
- Welk deel van DNA biedt de code voor eiwitten?
- Het geheim is bekend:de wereld heeft de Owyhees gevonden. Advocaten zeggen dat het tijd is om het land te beschermen
- Wat is het belangrijkste punt van evolutie in verwijzing naar ontwikkeling?
- Wat voedt de invasiestrategie van Salmonella?
- Vier hoofdgroepen organische verbindingen waaruit levende organismen bestaan
- Hoe kun je xxplain hoe de duim -eigenschap wordt bepaald met behulp van de volgende woorden allel domnate recessieve homozygote heterozygoot?
- Waar is de hoofdklier van het lichaam?
- Oud DNA brengt ons dichter bij het ontrafelen van geheimen over hoe de moderne mens evolueerde
- Welk type epitheel heeft langwerpige cellen met kernen?
- Afzonderlijke atomen targeten

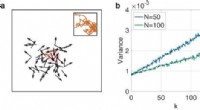
- De grootte van een collectief van zelfrijdende Vicsek-deeltjes afleiden uit de willekeurige beweging van een enkele eenheid
- Racebaangeluid draaglijk maken met natuurkunde

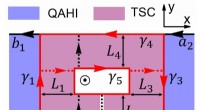
- Een magnetische methode om het transport van chirale Majorana-fermionen te regelen
- De voorspelling van vandaag:hoe de cruciale plasmadruk in toekomstige fusiefaciliteiten te voorspellen?

 Hoe keramiek het verhaal vertelt van de Chinese handel in de 14e eeuw
Hoe keramiek het verhaal vertelt van de Chinese handel in de 14e eeuw  Natuurkundigen vinden verrassende vervormingen in supergeleiders bij hoge temperatuur
Natuurkundigen vinden verrassende vervormingen in supergeleiders bij hoge temperatuur Hoge temperatuurrecords zullen de komende eeuw worden verbroken
Hoge temperatuurrecords zullen de komende eeuw worden verbroken Gaat het Japanse leger de ruimte in?
Gaat het Japanse leger de ruimte in?  Nettowinst SoftBank Groep over negen maanden bijna 70% gedaald
Nettowinst SoftBank Groep over negen maanden bijna 70% gedaald Qualcomm verzoekt nationale veiligheidsbeoordeling van Broadcom-bod
Qualcomm verzoekt nationale veiligheidsbeoordeling van Broadcom-bod Hoeveel centimeter is 22 mm?
Hoeveel centimeter is 22 mm?  Wat gebeurt er met de overblijfselen van de fusie van neutronensterren?
Wat gebeurt er met de overblijfselen van de fusie van neutronensterren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

