
Wetenschap
Wat is de orbitale notatie van thorium?
1. Elektronische configuratie:
* Thorium's elektronische configuratie: 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶ 5S² 4D¹⁰ 5P⁶ 6S² 4F¹⁴ 5d¹⁰ 6p⁶ 7s² 5f¹⁴ 6d²
2. Orbitale notatie:
De orbitale notatie vertegenwoordigt de verdeling van elektronen binnen elke subshell met pijlen. Elke pijl vertegenwoordigt een elektron en pijlen die in tegengestelde richtingen wijzen, vertegenwoordigen spins.
* 1S: ↑ ↓
* 2S: ↑ ↓
* 2p: ↑ ↓ ↑ ↓ ↑ ↓
* 3S: ↑ ↓
* 3P: ↑ ↓ ↑ ↓ ↑ ↓
* 4S: ↑ ↓
* 3D: ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
* 4P: ↑ ↓ ↑ ↓ ↑ ↓
* 5S: ↑ ↓
* 4D: ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
* 5p: ↑ ↓ ↑ ↓ ↑ ↓
* 6s: ↑ ↓
* 4f: ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
* 5d: ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
* 6p: ↑ ↓ ↑ ↓ ↑ ↓
* 7s: ↑ ↓
* 5f: ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
* 6d: ↑ ↑
Verklaring:
* Elk orbitaal (s, p, d, f) kan een maximaal aantal elektronen bevatten:
* S:2 elektronen
* P:6 elektronen
* D:10 elektronen
* F:14 elektronen
* De subshells worden gevuld in volgorde van toenemende energieniveaus.
Belangrijke opmerking: Thorium is een zwaar element en de orbitale notatie kan complexer zijn vanwege relativistische effecten en uitzonderingen op het AUFBAU -principe. Deze basisrepresentatie biedt echter een goed begrip van de elektronenverdeling in zijn atomaire orbitalen.
 Gereconstitueerde zijde kan meerdere keren sterker zijn dan de natuurlijke vezel en in verschillende vormen worden gemaakt
Gereconstitueerde zijde kan meerdere keren sterker zijn dan de natuurlijke vezel en in verschillende vormen worden gemaakt Hoeveel elektronen zijn er op elke baan voor kalium?
Hoeveel elektronen zijn er op elke baan voor kalium?  Barsten in perovskietfilms voor zonnecellen zijn gemakkelijk te genezen, studie vondsten
Barsten in perovskietfilms voor zonnecellen zijn gemakkelijk te genezen, studie vondsten Waarom komt er een dubbele vervangingsreactie op?
Waarom komt er een dubbele vervangingsreactie op?  Wat gebeurt er met de deeltjes in een zout als ze water oplost?
Wat gebeurt er met de deeltjes in een zout als ze water oplost?
 Niet meer Ibiza? 56 tot 65% van het strand op de Balearen zal permanent verloren gaan als gevolg van de klimaatcrisis
Niet meer Ibiza? 56 tot 65% van het strand op de Balearen zal permanent verloren gaan als gevolg van de klimaatcrisis De meeste EU-landen missen luchtkwaliteitsdoelen:rapport
De meeste EU-landen missen luchtkwaliteitsdoelen:rapport Wat maakt een natuurbrand in Californië het ergste? Sterfgevallen en omvang
Wat maakt een natuurbrand in Californië het ergste? Sterfgevallen en omvang  Nieuwe studie zegt dat wetenschappelijke basis voor EPA's Endangerment Finding sterker is dan ooit
Nieuwe studie zegt dat wetenschappelijke basis voor EPA's Endangerment Finding sterker is dan ooit Een nieuw rapport vat samen hoe klimaatverandering de watercyclus in Duitsland beïnvloedt
Een nieuw rapport vat samen hoe klimaatverandering de watercyclus in Duitsland beïnvloedt
Hoofdlijnen
- Actief transportmechanisme dat het potentiaalverschil van het membraan in stand houdt?
- Wijzigingen in de Amerikaanse importregels voor honden:wat ze zijn en waarom belangrijk voor hondenmensen
- Hoe groeifactor Midkine AMPK onderdrukt tijdens kankerprogressie
- Komt een van de plasma -eiwitten in uw afkomstig van voedselproteïnen?
- Nieuw begrip van hoe eiwitten werken
- Welk weefsel dat vet in ons lichaam opslaat?
- Licht schijnen op het sociale leven van virussen
- Internationaal onderzoek levert een uitgebreide levensboom op voor bloeiende planten
- Meer dan een getallenspel:nieuwe techniek meet microbiële gemeenschappen op biomassa
- Kegel of fles? De vorm die opsluiting detecteert

- Elektronenspectrometer ontcijfert kwantummechanische effecten

- Onderzoek naar supergeleiding onthult potentiële nieuwe toestand van materie
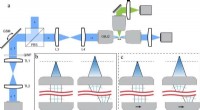
- Laterale scanning omzetten in axiale focussering om 3D-microscopie te versnellen
- Onderzoekers meten overgangen van één foton in een ongebonden elektron
 Het probleem van zelfrijdende trolleys:hoe zullen toekomstige AI-systemen de meest ethische keuzes maken voor ons allemaal?
Het probleem van zelfrijdende trolleys:hoe zullen toekomstige AI-systemen de meest ethische keuzes maken voor ons allemaal? Wat is de rol van een lamp op een laboratoriumthermometer?
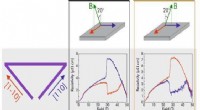
Wat is de rol van een lamp op een laboratoriumthermometer?  Driehoekige honingraten:natuurkundigen ontwerpen nieuw kwantummateriaal
Driehoekige honingraten:natuurkundigen ontwerpen nieuw kwantummateriaal Is er daglichtbesparingen in India?
Is er daglichtbesparingen in India?  De kwaliteit van de laserstraalvormgeving kan zonder extra kosten worden verbeterd
De kwaliteit van de laserstraalvormgeving kan zonder extra kosten worden verbeterd Wanneer is Mercury Retrograde gecreëerd?
Wanneer is Mercury Retrograde gecreëerd?  Onderzoek op nanoschaal zou betere manieren kunnen opleveren om kwaadaardige cellen te identificeren en te volgen
Onderzoek op nanoschaal zou betere manieren kunnen opleveren om kwaadaardige cellen te identificeren en te volgen Nieuwe bevestiging van Einsteins algemene relativiteitstheorie
Nieuwe bevestiging van Einsteins algemene relativiteitstheorie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

