
Wetenschap
Hoe verschillen de 3 staten van materie van elkaar?
Hier is een uitsplitsing:
solide:
* arrangement: Deeltjes zijn strak verpakt in een normaal, herhaaldelijk patroon (kristalrooster).
* Beweging: Trillen in vaste posities, met beperkte beweging.
* Vorm: Duidelijke vorm.
* Volume: Zeker volume.
* Compressibiliteit: Zeer lage samendrukbaarheid.
vloeistof:
* arrangement: Deeltjes zijn dicht bij elkaar, maar minder georganiseerd dan vaste stoffen.
* Beweging: Ga vrij rond, maar blijf dicht bij elkaar.
* Vorm: Neemt de vorm van de container aan.
* Volume: Zeker volume.
* Compressibiliteit: Enigszins samendrukbaar.
gas:
* arrangement: Deeltjes zijn ver uit elkaar en willekeurig gerangschikt.
* Beweging: Beweeg snel en onafhankelijk, met hoge kinetische energie.
* Vorm: Neemt de vorm van de container aan.
* Volume: Vult de hele container.
* Compressibiliteit: Zeer samendrukbaar.
Hier is een eenvoudige analogie:
* solide: Stel je een overvolle doos met knikkers voor. Ze kunnen slechts iets op hun plaats trillen.
* vloeistof: Stel je een zak met knikkers voor. Ze kunnen bewegen, maar blijven dicht bij elkaar.
* gas: Stel je voor dat knikkers verspreid over een kamer. Ze bewegen vrij in alle richtingen.
Belangrijkste verschillen:
* Dichtheid: Vaste stoffen zijn de dichtste, gevolgd door vloeistoffen en vervolgens gassen.
* diffusie: Gassen diffunderen het gemakkelijkst, gevolgd door vloeistoffen en vervolgens vaste stoffen.
* Thermische uitbreiding: Gassen breiden het meest uit wanneer ze worden verwarmd, gevolgd door vloeistoffen en vervolgens vaste stoffen.
Belangrijke opmerking:
Dit zijn vereenvoudigde beschrijvingen. De staten van materie zijn niet altijd verschillend, en er kunnen tussenliggende toestanden zijn, zoals plasma's en superfluïden.
Hoofdlijnen
- Hoe nuttige darmbacteriën de kolonisatie van de gastheer en de vorming van biofilms optimaliseren
- Hoe laat de celtheorie zien dat de evolutie onjuist was?
- Wat maakt het meeste eiwit voor cel?
- Wat is de mate van interne en externe orde in organismen?
- De opwarming van de aarde kan de leefgebieden van muggen een impuls geven, zo blijkt uit onderzoek
- E. coli:het ideale transportmiddel voor vaccins van de volgende generatie?
- Welke soort ik zou waarschijnlijk walvissen bestuderen?
- Verplichte etikettering op genetisch gemanipuleerde voedingsmiddelen kan de aankopen van klanten verminderen
- Welk type homeostatische mechanismen worden ingebouwd in de gereguleerde organen?
- Computers creëren recept voor twee nieuwe magnetische materialen

- Studie ontrafelt lang bestaande Fermi-puzzel gekoppeld aan niet-lineaire systemen

- Buigbare lichtcommunicatie met gegevensdragende vrije ruimte

- Onderzoekers ontwikkelen compact on-chip apparaat voor het detecteren van elektrische veldgolfvormen met attoseconde tijdresolutie

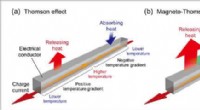
- 'S Werelds eerste directe waarneming van het magneto-Thomson-effect
 Het werk van wetenschappers kan een antwoord bieden op het mysterie van Mars
Het werk van wetenschappers kan een antwoord bieden op het mysterie van Mars U oefent een kracht van 25n uit op de kop Thumbtack heeft straal 5 mm Wat is druk op uw duim?
U oefent een kracht van 25n uit op de kop Thumbtack heeft straal 5 mm Wat is druk op uw duim?  NASA-satellietgegevens tonen Humbertos structuurverandering
NASA-satellietgegevens tonen Humbertos structuurverandering Staat Haïti op een grens tussen twee platen of in het midden van één plaat?
Staat Haïti op een grens tussen twee platen of in het midden van één plaat?  Warmere temperaturen veroorzaken een afname van de belangrijkste afvoermaatregel
Warmere temperaturen veroorzaken een afname van de belangrijkste afvoermaatregel NASA ziet krachtige tropische cycloon tussen Vanuatu en Nieuw-Caledonië
NASA ziet krachtige tropische cycloon tussen Vanuatu en Nieuw-Caledonië Kunnen geiten de beste vriend van de mens worden?
Kunnen geiten de beste vriend van de mens worden?  Hoe een 3D-perimeter te berekenen
Hoe een 3D-perimeter te berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


