
Wetenschap
Beschrijf de binding in een watermolecuul?
1. Covalente bindingen:
* binnen het molecuul: Elk waterstofatoom deelt zijn enkele elektron met het zuurstofatoom en vormt een enkele covalente binding. Dit delen van elektronen creëert een stabiel molecuul.
* polariteit: Zuurstof is elektronegatiefer dan waterstof, wat betekent dat het de gedeelde elektronen sterker aantrekt. Dit creëert een gedeeltelijke negatieve lading (Δ-) op het zuurstofatoom en een gedeeltelijke positieve lading (δ+) op elk waterstofatoom. Dit maakt het watermolecuul polair.
2. Intermoleculaire krachten:
* Waterstofbindingen: De sterke polariteit van het watermolecuul leidt tot waterstofbinding. De gedeeltelijk positieve waterstofatomen op één watermolecuul worden aangetrokken door het gedeeltelijk negatieve zuurstofatoom op een ander watermolecuul. Deze waterstofbruggen zijn relatief sterke intermoleculaire krachten, verantwoordelijk voor veel van de unieke eigenschappen van water.
* van der Waals krachten: Hoewel zwakker dan waterstofbindingen, spelen deze tijdelijke, fluctuerende krachten ook een rol in de interacties tussen watermoleculen.
Samenvatting:
* Het watermolecuul wordt bij elkaar gehouden door covalente bindingen tussen de zuurstof- en waterstofatomen.
* De polaire aard van het watermolecuul resulteert in waterstofbinding tussen moleculen, waardoor water een zeer samenhangende en veelzijdige stof is.
gevolgen van deze binding:
* Hoog kookpunt: Waterstofbindingen vereisen veel energie om te breken, wat leidt tot het relatief hoge kookpunt van water.
* Goed oplosmiddel: Met de polariteit van het water kan het veel polaire stoffen oplossen en het de titel van "Universal Solvent" oplossen.
* Oppervlaktespanning: De sterke waterstofbindingen creëren oppervlaktespanning, waardoor water druppeltjes kan vormen.
Deze combinatie van covalente binding en sterke intermoleculaire krachten maakt water een uniek en essentieel molecuul voor het leven op aarde.
 Hoeveel verschillende substituenten zijn er nodig op een koolstofatoom om chiraal te zijn?
Hoeveel verschillende substituenten zijn er nodig op een koolstofatoom om chiraal te zijn?  Wat zijn de vergelijkingen voor elk van de volgende radioactieve vervalreacties Alpha -uitstoot door Thorium 228 en Beta Aluminium 28?
Wat zijn de vergelijkingen voor elk van de volgende radioactieve vervalreacties Alpha -uitstoot door Thorium 228 en Beta Aluminium 28?  Wat is de chemische naam voor PDCL2?
Wat is de chemische naam voor PDCL2?  Hoe weet je dat kalium een alkalimetaal zeer reactief?
Hoe weet je dat kalium een alkalimetaal zeer reactief?  Beschrijf de volgende term in synthetische polymeren syndiotactiek?
Beschrijf de volgende term in synthetische polymeren syndiotactiek?
 Wat is het lichtste levende dingen ter wereld?
Wat is het lichtste levende dingen ter wereld?  Henri upgrade naar orkaan omdat het de Amerikaanse kust bedreigt
Henri upgrade naar orkaan omdat het de Amerikaanse kust bedreigt Arctisch kustvast zee-ijs bedreigd door klimaatverandering, studie vondsten
Arctisch kustvast zee-ijs bedreigd door klimaatverandering, studie vondsten Naties bij klimaatbesprekingen over universele emissieregels
Naties bij klimaatbesprekingen over universele emissieregels Tientallen jaren oude verontreinigende stoffen die uit de Himalaya-gletsjers smelten
Tientallen jaren oude verontreinigende stoffen die uit de Himalaya-gletsjers smelten
Hoofdlijnen
- Welke structuren dragen voedingsstoffen door een plant?
- In welke fase van de celcyclus vindt veel eiwitsynthese plaats?
- Wat zijn de functies van glasplaat & dekglaasjes?
- Hoe verschilt het klonen van genen van dieren?
- Onderzoekers bepalen hoe de bacteriën van veteranenziekten zich vermenigvuldigen en ziekten veroorzaken
- Wat heeft een celmembraan dat het voor bepaalde moleculen gemakkelijker maakt om het membraan over te steken?
- Hoe erfelijke ziekten werken
- Waarom zijn geteisterde eigenschappen onbelangrijk in het evolutieproces?
- Wat zijn eukarotische heterotrofen met celwanden?
- Chemisch etende bacteriën verwijderen waarschijnlijk kankerverwekkend uit verontreinigd water

- Overlevingsstrategie:hoe één enzym bacteriën helpt herstellen van blootstelling aan antibiotica

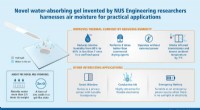
- Nieuwe hydrogel benut luchtvochtigheid voor praktische toepassingen
- Het produceren van heilzaam propyleen terwijl het een belangrijk broeikasgas verbruikt
- Poreus silica beschermt de nikkelkatalysator
 Welke 4 fasen worden gevonden in de M -fase?
Welke 4 fasen worden gevonden in de M -fase?  Maak kennis met de made:hoe dit vleesminnende, kontademende wonder ons helpt moorden op te lossen
Maak kennis met de made:hoe dit vleesminnende, kontademende wonder ons helpt moorden op te lossen  Wanneer afscheid nemen? Enquête werpt licht op moeilijke beslissingen voor hondenbezitters
Wanneer afscheid nemen? Enquête werpt licht op moeilijke beslissingen voor hondenbezitters  Visioenen van de toekomst:vijf duistere waarschuwingen uit de wereld van klassieke sciencefiction
Visioenen van de toekomst:vijf duistere waarschuwingen uit de wereld van klassieke sciencefiction Je bent een reeks buizen die worden gevonden in de celtransporteiwitten en andere dingen ook wat jij?
Je bent een reeks buizen die worden gevonden in de celtransporteiwitten en andere dingen ook wat jij?  Hoeveel energie bevat een banaan?
Hoeveel energie bevat een banaan?  Welke planeten hebben een korte revolutieperiode binnen of uiterlijk?
Welke planeten hebben een korte revolutieperiode binnen of uiterlijk?  Het uitschakelen van de Niagarawatervallen zou inzicht kunnen opleveren over hoe watervallen canyons uitsnijden, zegt een expert
Het uitschakelen van de Niagarawatervallen zou inzicht kunnen opleveren over hoe watervallen canyons uitsnijden, zegt een expert
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

