
Wetenschap
Wat is het vermogen van watermolueculen om waterstofbruggen te vormen met andere kritiek?
1. Hoog kookpunt en smeltpunt:
* Waterstofbindingen vereisen een aanzienlijke hoeveelheid energie om te breken. Dit betekent dat water een relatief hoog kookpunt (100 ° C) en smeltpunt (0 ° C) heeft in vergelijking met andere moleculen van vergelijkbare grootte. Hierdoor kan water bestaan als een vloeistof over een breed scala aan temperaturen, essentieel voor het leven op aarde.
2. Hoge specifieke warmtecapaciteit:
* Water kan veel warmte absorberen voordat de temperatuur aanzienlijk toeneemt. Dit komt door de energie die nodig is om waterstofbruggen te doorbreken. Deze hoge specifieke warmtecapaciteit helpt de temperatuur te reguleren, waardoor het ideaal is voor biologische systemen en klimaten.
3. Uitstekend oplosmiddel:
* De polariteit en het vermogen van water om waterstofbindingen te vormen, maakt het een uitstekend oplosmiddel voor veel polaire en ionische stoffen. Dit zorgt voor het transport van voedingsstoffen en afval binnen organismen en in het milieu.
4. Cohesie en hechting:
* Waterstofbindingen tussen watermoleculen leiden tot sterke samenhangende krachten (aantrekkingskracht tussen watermoleculen) en lijmkrachten (aantrekkingskracht tussen watermoleculen en andere oppervlakken). Dit draagt bij aan oppervlaktespanning, capillaire werking en het vermogen van water om door planten en andere systemen te bewegen.
5. Biologisch belang:
* Water is het primaire oplosmiddel in levende organismen, het faciliteren van biochemische reacties en transportstoffen.
* Waterstofbinding is cruciaal voor eiwitstructuur en -functie, DNA -structuur en celmembraanstabiliteit.
Samenvattend: Het waterstofbindingsvermogen van watermoleculen is de basis voor veel van zijn essentiële eigenschappen, waardoor het een kritieke component voor het leven op aarde is.
 Wat gebeurt er als overgangsmetalen reageren met de lucht?
Wat gebeurt er als overgangsmetalen reageren met de lucht?  Chemische vergelijking voor maagzuur en calciumcarbonaat?
Chemische vergelijking voor maagzuur en calciumcarbonaat?  Wat is de beweging van moleculen van drukke gebieden tot minder genoemd?
Wat is de beweging van moleculen van drukke gebieden tot minder genoemd?  Wat is de scheidingsmethode voor zwavel en natriumchloride?
Wat is de scheidingsmethode voor zwavel en natriumchloride?  Azijn en zuiveringszout:een schoonmaaktruc of gewoon een hoop bruis?
Azijn en zuiveringszout:een schoonmaaktruc of gewoon een hoop bruis?
 De maalstroom meten:hoe sedimenten bewegen en bezinken tijdens sterke stromingen in onderzeese canyons
De maalstroom meten:hoe sedimenten bewegen en bezinken tijdens sterke stromingen in onderzeese canyons Rambowortel kan helpen bij klimaatactie, vredesopbouw, en milieukwesties
Rambowortel kan helpen bij klimaatactie, vredesopbouw, en milieukwesties Klimaat:Jodiumzuur beïnvloedt wolkenvorming op de Noordpool
Klimaat:Jodiumzuur beïnvloedt wolkenvorming op de Noordpool Wat beschrijft diversiteit het beste in termen van natuurlijke selectie?
Wat beschrijft diversiteit het beste in termen van natuurlijke selectie?  Abiotische factoren van een regenwoud
Abiotische factoren van een regenwoud
Hoofdlijnen
- Wat is de functie van aerobe ademhaling?
- Waarom hebben planten lysosomen?
- Wat is een flexibele structuur die cel bij elkaar houdt?
- Hoe een verandering van één gen leidde tot nieuwe soorten Monkeyflower
- Zijn er dingen als organismen met één cel?
- Hoe beleid te ontwerpen dat zowel de aquacultuur als de kleinschalige visserij ondersteunt
- Wat is een B-cel?
- Wat zijn enkele veel voorkomende ziekten die worden veroorzaakt door anaerobe bacteriën?
- Wat is de 3 belangrijke gebeurtenis die leidde tot het begrijpen van de structuur van DNA?
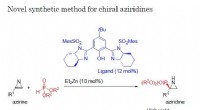
- Nieuwe chemische synthesemethode kan een opwindende reeks nieuwe verbindingen produceren
- Hoe RNA werd gevormd bij de oorsprong van het leven
- Ingenieurs ontwikkelen recept om kogelvrije vesten drastisch te versterken

- Nieuw kunstmatig enzym breekt taaie, houtachtige lignine af:onderzoek toont belofte voor de ontwikkeling van een nieuwe hernieuwbare energiebron

- Massaspectrometriebeeldvorming maakt ingrediënten, additieven en contaminanten van voedsel zichtbaar

 Als een boek op de plank staat, welke kracht oefent het boek dan uit?
Als een boek op de plank staat, welke kracht oefent het boek dan uit?  Wetenschap zegt:waarom biodiversiteit belangrijk voor je is
Wetenschap zegt:waarom biodiversiteit belangrijk voor je is Wat is het momentum van een cheetah van 57 kg die op 27 ms naar het noorden loopt?
Wat is het momentum van een cheetah van 57 kg die op 27 ms naar het noorden loopt?  Ontwerp en validatie van een meerlaagse thermische emitter van wereldklasse met behulp van machine learning
Ontwerp en validatie van een meerlaagse thermische emitter van wereldklasse met behulp van machine learning Wat betekent het woord experiment?
Wat betekent het woord experiment?  Welk proces vertegenwoordigt deze vergelijking glucose -zuurstof enzymen koolstofdioxide water ATP -energie?
Welk proces vertegenwoordigt deze vergelijking glucose -zuurstof enzymen koolstofdioxide water ATP -energie?  Hoe vaak is koolstofzuurstof en waterstof in suiker?
Hoe vaak is koolstofzuurstof en waterstof in suiker?  Russische hulpraket brengt Amerikaanse satelliet in een baan om de aarde
Russische hulpraket brengt Amerikaanse satelliet in een baan om de aarde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

