
Wetenschap
Welke delen van een atoom nemen deel aan chemische reacties?
Dit is waarom:
* elektronen zijn de enige subatomaire deeltjes die gemakkelijk kunnen worden overgedragen of gedeeld. Protonen en neutronen bevinden zich in de kern en worden bij elkaar gehouden door sterke nucleaire krachten. Deze krachten zijn veel sterker dan de krachten die betrokken zijn bij chemische reacties.
* valentie -elektronen bepalen de reactiviteit van een atoom. Het aantal valentie -elektronen beïnvloedt hoe een atoom zal interageren met andere atomen om chemische bindingen te vormen. Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele configuratie van acht valentie -elektronen (de "octetregel") te bereiken.
Hier zijn enkele voorbeelden van hoe elektronen deelnemen aan chemische reacties:
* ionische binding: Atomen winnen of verliezen elektronen om ionen te vormen. Natrium (NA) verliest bijvoorbeeld één elektron om een positief geladen natriumion (Na+) te worden, terwijl chloor (CL) één elektron laat een negatief geladen chloride-ion (Cl-) worden. De tegengesteld geladen ionen trekken elkaar vervolgens aan en vormen een ionische binding.
* Covalente binding: Atomen delen elektronen om moleculen te vormen. Twee waterstofatomen (H) delen bijvoorbeeld hun enkele valentie -elektron om een covalente binding te vormen en een waterstofmolecuul te creëren (H2).
* Metallic binding: Elektronen worden gedelokaliseerd en gedeeld met een groot aantal metaalatomen. Dit geeft metalen hun unieke eigenschappen, zoals geleidbaarheid en kneedbaarheid.
Samenvattend zijn het de elektronen in de buitenste schaal van een atoom die verantwoordelijk zijn voor het chemische gedrag van dat atoom.
 Plantaardige en recyclebare plastic flessen met schillen van citrusvruchten als grondstof
Plantaardige en recyclebare plastic flessen met schillen van citrusvruchten als grondstof Een chemische reactie die van cruciaal belang is voor verschillende industrieën is zojuist groener geworden
Een chemische reactie die van cruciaal belang is voor verschillende industrieën is zojuist groener geworden  Proces voor het maken van papieren handdoeken
Proces voor het maken van papieren handdoeken  Welke menselijke acties verhogen de hoeveelheid koolstofdoxide in de atmosfeer?
Welke menselijke acties verhogen de hoeveelheid koolstofdoxide in de atmosfeer?  Hoe noem je de kleur van poeder gemaakt door een rots?
Hoe noem je de kleur van poeder gemaakt door een rots?
 Toekomst van technologie voor planeetkoeling:studie creëert routekaart voor onderzoek naar geo-engineering
Toekomst van technologie voor planeetkoeling:studie creëert routekaart voor onderzoek naar geo-engineering Hoe gebruiken dieren de rivier de berkenboom?
Hoe gebruiken dieren de rivier de berkenboom?  Inzicht in multi-decadale veranderingen in de opwarming van de aarde
Inzicht in multi-decadale veranderingen in de opwarming van de aarde Parasitisme in de toendra
Parasitisme in de toendra  Waarom merkte Darwin op dat hij het woord hoger of lager heeft gebruikt bij het verwijzen van evolutie van planten en dieren?
Waarom merkte Darwin op dat hij het woord hoger of lager heeft gebruikt bij het verwijzen van evolutie van planten en dieren?
Hoofdlijnen
- Wat zijn 3 functies van de navelstreng?
- Waarom zijn mensen koel bloedig?
- Wat hebben de cellen van protisten die schimmels en dieren gemeen hebben?
- Waarom creëren Britse wetenschappers een hybride mens-varken?
- Die eenzame, steile gomboom op een boerderij? Het is een reddingslijn voor koala's
- Zet deze termen in volgorde eiwit DNA-transcriptie vertaling en RNA de stroom van genetische informatie een cel?
- Wat gebeurt er in een voedselketen en web als de bevolkingsgrootte van een organisme verandert?
- Welke twee wetenschapper ontdekte deeltjes die de kern vormen?
- Het vouwen van DNA-origami vastleggen met een nieuw dynamisch model
- Hoe melk een dierlijk lichaam goed doet?

- Onderzoekers rapporteren over celdoorlatende nanobodies
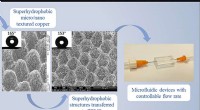
- Nieuw productieproces creëert superkleine kanalen om water af te weren en medische, elektronische apparaten
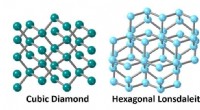
- We hebben in minuten zonder hitte diamanten gemaakt door de kracht van een asteroïdebotsing na te bootsen
- Raman-spectroscopie biedt een niet-invasieve manier om herprogrammering van cellen te volgen

 Een nieuw recept voor luchtstabiel en hoogkristallijn radicaal-gebaseerd coördinatiepolymeer
Een nieuw recept voor luchtstabiel en hoogkristallijn radicaal-gebaseerd coördinatiepolymeer De smalle bindende zak die zich uit het begin van de dikke darm uitstrekt, een overblijfsel orgaan zonder bekende functie?
De smalle bindende zak die zich uit het begin van de dikke darm uitstrekt, een overblijfsel orgaan zonder bekende functie?  Waarom is curium 242 niet geschikt voor gebruik in rookmelders?
Waarom is curium 242 niet geschikt voor gebruik in rookmelders?  UCSD-chemici produceren eerste RNA-nanovierkant met hoge resolutie
UCSD-chemici produceren eerste RNA-nanovierkant met hoge resolutie Wat zijn twee soorten bindingen die de atomen in een verbinding bij elkaar houden?
Wat zijn twee soorten bindingen die de atomen in een verbinding bij elkaar houden?  Welk type grens is de Juan de Fuca -plaat?
Welk type grens is de Juan de Fuca -plaat?  loodgieter, grafenes laatste neef, gerealiseerd op de nano-waterkubus
loodgieter, grafenes laatste neef, gerealiseerd op de nano-waterkubus Slecht nieuws:CO2-uitstoot stijgt in 2018, zegt IEA-chef
Slecht nieuws:CO2-uitstoot stijgt in 2018, zegt IEA-chef
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

