
Wetenschap
Waarom is water een veelzijdig oplosmiddel?
1. Polariteit:
* waterstofbinding: Watermoleculen zijn polair, wat betekent dat ze een enigszins positief uiteinde hebben (waterstofatomen) en een enigszins negatief uiteinde (zuurstofatoom). Met deze polariteit kunnen ze sterke waterstofbruggen vormen met andere polaire moleculen.
* Mogelijkheid om polaire opgeloste stoffen op te lossen: Deze waterstofbinding zorgt ervoor dat water gemakkelijk veel polaire stoffen, zoals suikers, zouten en zuren, oplost door sterke interacties met hun polaire groepen te vormen.
2. Hoge diëlektrische constante:
* Verzwakking van elektrostatische interacties: De hoge diëlektrische constante van het water verzwakt de elektrostatische interacties tussen ionen in oplossing, waardoor ze gemakkelijker kunnen scheiden en oplossen.
3. Cohesie en hechting:
* Oppervlaktespanning: Watermoleculen zijn zeer samenhangend, wat betekent dat ze zich aan elkaar houden als gevolg van waterstofbinding. Dit leidt tot oppervlaktespanning, waardoor het druppeltjes kan vormen.
* hechting: Water houdt zich ook aan andere polaire oppervlakken, wat bijdraagt aan zijn vermogen om stoffen op te lossen en te transporteren.
4. Temperatuurstabiliteit:
* Hoge warmtecapaciteit: Water heeft een hoge warmtecapaciteit, wat betekent dat het veel warmte -energie kan absorberen voordat de temperatuur aanzienlijk stijgt. Dit helpt matige temperatuurveranderingen in organismen en de omgeving.
5. Overvloed:
* Universeel oplosmiddel: Water is het meest voorkomende oplosmiddel op aarde, waardoor het direct beschikbaar is voor het oplossen en transporteren van verschillende stoffen.
Samenvattend is de veelzijdigheid van het water als oplosmiddel te wijten aan de polariteit, hoge diëlektrische constante, samenhangende en lijm eigenschappen, temperatuurstabiliteit en overvloed. Deze factoren maken water essentieel voor het leven en spelen cruciale rollen in biologische, chemische en geologische processen.
 Wat wordt gevormd als de waterdamp afkoelt?
Wat wordt gevormd als de waterdamp afkoelt?  wat is de Lewis-structuur voor H2Te?
wat is de Lewis-structuur voor H2Te?  Wat is de conclusie van experimentneutralisatiezuur en base?
Wat is de conclusie van experimentneutralisatiezuur en base?  Wat zijn enkele voorbeelden van stoffen die gevaarlijk zijn voor het milieu?
Wat zijn enkele voorbeelden van stoffen die gevaarlijk zijn voor het milieu?  Wetenschappers vinden nieuwe methode om elektronische eigenschappen van nanokristallen te controleren
Wetenschappers vinden nieuwe methode om elektronische eigenschappen van nanokristallen te controleren
 Welk effect heeft de hoeveelheid licht op de groei van planten?
Welk effect heeft de hoeveelheid licht op de groei van planten?  Hoe beschrijf je het klimaat?
Hoe beschrijf je het klimaat?  Milieugroep plant nieuwe Nederlandse juridische stappen voor schone lucht
Milieugroep plant nieuwe Nederlandse juridische stappen voor schone lucht Californische klimaatwet aangeprezen als mondiaal model geconfronteerd met belangrijke test
Californische klimaatwet aangeprezen als mondiaal model geconfronteerd met belangrijke test Nieuw ontdekt fossiel onthult dat oude pinguïns enorm waren
Nieuw ontdekt fossiel onthult dat oude pinguïns enorm waren
Hoofdlijnen
- Waarom is de mitochondria ontstaan?
- Wat is een primaire functie van het celmembraan?
- Welke van de volgende koninkrijken omvatten organismen die hun eigen voedsel kunnen maken?
- Hoe schimmels hebben bijgedragen aan het ontstaan van het leven zoals wij dat kennen
- Hoe jonge oesters de metamorfose van de vleesetende buikpotige Rapana venosa beïnvloeden
- Welke cellulaire structuren worden aangetroffen in de epidermale cellen van mensen maar geen celbladeren?
- Wat is Bioshere?
- Welke stap is niet bereikt door wetenschappers die de oorsprong van het leven bestuderen?
- Wat zijn C2-planten?
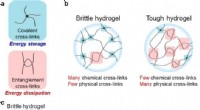
- Een universele methode om eenvoudig stevige en rekbare hydrogels te ontwerpen
- Neutronen ontsluiten eigenschappen van nieuw poreus metaalhydride voor mogelijke nieuwe toepassingen voor energieopslag

- Nieuwe 3D-printtechniek produceert levende 4D-materialen

- Superstaalproject bereikt grote doorbraak

- Nieuw biomateriaal kan beschermen tegen schadelijke straling
 Apollo de Griekse King of Light?
Apollo de Griekse King of Light?  Wat vormt zich wanneer een gas- of vloeistof warmte overbrengt terwijl het beweegt?
Wat vormt zich wanneer een gas- of vloeistof warmte overbrengt terwijl het beweegt?  Waarom heeft chroom een hoog kookpunt?
Waarom heeft chroom een hoog kookpunt?  Mineralen kunnen diep in de korst vormen door wat?
Mineralen kunnen diep in de korst vormen door wat?  Wat zijn de temperatuurbereiken van vloeibaar magma?
Wat zijn de temperatuurbereiken van vloeibaar magma?  Een mechanisme van hoe biodiversiteit ontstaat
Een mechanisme van hoe biodiversiteit ontstaat  Lasers kunnen veelgevraagde bandgaten in grafeen produceren
Lasers kunnen veelgevraagde bandgaten in grafeen produceren Wat zijn vier verschillen tussen de oceanische korst en continentale korst?
Wat zijn vier verschillen tussen de oceanische korst en continentale korst?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

