
Wetenschap
Waar zijn watermoleculen polair mee?
Dit is waarom:
* zuurstof is meer elektronegatief: Zuurstof heeft een sterkere trek aan elektronen dan waterstof. Dit betekent dat de gedeelde elektronen in de O-H-obligaties meer tijd dichter bij het zuurstofatoom besteden.
* ongelijke laadverdeling: Het zuurstofatoom eindigt met een enigszins negatieve lading (Δ-) omdat het een hogere elektronendichtheid heeft. De waterstofatomen, die enige elektronendichtheid hebben verloren, worden enigszins positief (Δ+).
* Dipoolmoment: Deze ongelijke ladingsverdeling creëert een dipoolmoment, waarbij het positieve uiteinde wijst naar de waterstofatomen en het negatieve uiteinde dat naar het zuurstofatoom wijst.
Met deze polariteit kunnen watermoleculen waterstofbruggen met elkaar vormen en met andere polaire moleculen, wat cruciaal is voor veel van zijn eigenschappen, zoals zijn hoge kookpunt, oppervlaktespanning en het vermogen om veel stoffen op te lossen.
 Het loggen van brandwonden verbergt industriële vervuiling in naam van de veiligheid van de gemeenschap
Het loggen van brandwonden verbergt industriële vervuiling in naam van de veiligheid van de gemeenschap Activiteit in een kamer zorgt ervoor dat nanodeeltjes die overblijven van consumentensprays in beweging komen, zo blijkt uit onderzoek
Activiteit in een kamer zorgt ervoor dat nanodeeltjes die overblijven van consumentensprays in beweging komen, zo blijkt uit onderzoek  Wat is uniek aan sfeer?
Wat is uniek aan sfeer?  Koeler voor delen van Europa, Spanje bestrijdt bosbranden
Koeler voor delen van Europa, Spanje bestrijdt bosbranden Gebouw te dicht bij het water. Het is belachelijk! Opkopen na overstromingen tonen noodzaak tot klimaatadaptatie
Gebouw te dicht bij het water. Het is belachelijk! Opkopen na overstromingen tonen noodzaak tot klimaatadaptatie
Hoofdlijnen
- Komt een plantengroei op bij de stengel laat bloemen en wortels achter?
- Om al het eiwitten te produceren dat een cel nodig heeft om transcriptie te hebben plaatsgevonden?
- Voeren krekels zich aan algen en water riet?
- Is de term cerebrale dominantie het halfrond aan dat dominant is voor taal?
- Hoe zijn organismen gerelateerd aan evolutie?
- Waar komen aminozuren in uw lichaam vandaan?
- Bepalen genen al uw geërfde eigenschappen?
- Wat is de koloniemorfologie van Edwardsiella Tarda?
- Hoe worden vissen aangepast aan de zee?
- Unieke moleculaire CODE:paramagnetische codering van moleculen

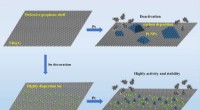
- Onderzoekers boeken vooruitgang in groene chemie met nieuwe katalysator voor reductie van koolstofdioxide

- Leerachtige materialen maken van schimmels

- Onderzoekers onthullen complexe defectstructuur van Li-ion-kathodemateriaal
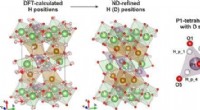
- Nieuwe styreenproductiemethode verbetert de stabiliteit, dehydrogeneringsactiviteit
 Wat gebruikt minder energie per bad of douche?
Wat gebruikt minder energie per bad of douche?  Welke vormen kan energie aannemen?
Welke vormen kan energie aannemen?  Onderzoekers systematiseren de methoden voor de synthese van azocine-bevattende systemen
Onderzoekers systematiseren de methoden voor de synthese van azocine-bevattende systemen Hoe vulkanen werken
Hoe vulkanen werken  Hooggevoelige chemische beeldvorming op nanoschaal met harde x-ray nano-XANES
Hooggevoelige chemische beeldvorming op nanoschaal met harde x-ray nano-XANES Koolstofnanobuisjes zijn veelbelovend voor snelle genetische sequencing (met video)
Koolstofnanobuisjes zijn veelbelovend voor snelle genetische sequencing (met video)  Hoe gletsjers werken
Hoe gletsjers werken  Wat is de hoogste temperatuurbrand?
Wat is de hoogste temperatuurbrand?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

