
Wetenschap
Hoe beïnvloedt activeringsenergie chemische reacties?
1. Reactiesnelheid:
* Hogere activeringsenergie =langzamere reactie: Een hogere activeringsenergie betekent dat er meer energie nodig is om reactanten te bereiken om de overgangstoestand te bereiken en producten te vormen. Dit resulteert in een langzamere reactiesnelheid.
* Lagere activeringsenergie =snellere reactie: Een lagere activeringsenergie vereist minder energie voor de reactie om verder te gaan, wat leidt tot een snellere reactiesnelheid.
2. Reactiesnelheid constant:
* Activeringsenergie is direct gerelateerd aan de snelheidsconstante (k) van een reactie door de Arrhenius-vergelijking: k =a * exp (-ea/rt) , waar:
* K is de snelheidsconstante
* A is de pre-exponentiële factor
* EA is de activeringsenergie
* R is de ideale gasconstante
* T is de temperatuur
3. Evenwichtsconstante:
* Hoewel activeringsenergie de reactiesnelheid direct beïnvloedt, heeft dit geen invloed op de evenwichtsconstante (K). De evenwichtsconstante hangt af van het verschil in energie tussen reactanten en producten, niet van de activeringsenergie.
4. Katalysatoren:
* Katalysatoren werken door de activeringsenergie van een reactie te verlagen. Ze bieden een alternatieve reactieroute met een lagere energiebarrière, waardoor de reactiesnelheid wordt verhoogd zonder het evenwicht te beïnvloeden.
5. Temperatuurafhankelijkheid:
* Verhogende temperatuur biedt meer energie om moleculen van reactant te reactant, waardoor het voor hen gemakkelijker wordt om de activeringsenergiebarrière te overwinnen. Dit leidt tot een exponentiële toename van de reactiesnelheid.
Samenvattend:
Activeringsenergie is een cruciale factor die de snelheid van een chemische reactie bepaalt. Een hogere activeringsenergie leidt tot een langzamere reactie, terwijl een lagere activeringsenergie resulteert in een snellere reactie. Katalysatoren kunnen reacties versnellen door de activeringsenergie te verlagen, terwijl temperatuurveranderingen de reactiesnelheid beïnvloeden door de beschikbare energie te wijzigen om de activeringsenergiebarrière te overwinnen.
 Bereken de moleculaire formules van verbindingen met de volgende emprische en molaire massa's C2H5 58G mol?
Bereken de moleculaire formules van verbindingen met de volgende emprische en molaire massa's C2H5 58G mol?  De vijfhoek en de boon - de structuur van een eiwit van het immuunsysteem opnieuw tekenen
De vijfhoek en de boon - de structuur van een eiwit van het immuunsysteem opnieuw tekenen De massa van een molzink is ongeveer?
De massa van een molzink is ongeveer?  Welke elektronen uit het metaal vormen gedelokaliseerde elektronen?
Welke elektronen uit het metaal vormen gedelokaliseerde elektronen?  Welke term verwijst naar de beweging van moleculen uit een hogere concentratie een gebied lagere concentratie?
Welke term verwijst naar de beweging van moleculen uit een hogere concentratie een gebied lagere concentratie?
Hoofdlijnen
- Wat is een uniceller organisme?
- Wanneer een wetenschapper een goed opgeleide gok doet over wat het juiste antwoord op het wetenschapsexperiment zou kunnen zijn?
- Waarom werden dieren uitgevonden?
- Welk genotype illustreert codominantie van allelen die het bloedgroep bij mensen regelen?
- Wat zijn de kenmerken van domeinbacteriën?
- Cellen gebruiken actieve transporteiwitten om?
- Ananas mint genetische blauwdruk:een uitgebreide genoomassemblage
- Lijst met toepassingen van elektroforese
- Hoe produceert ATP-snythase ATP?
- Ammoniaksynthese door elektroreductie van stikstof op zwarte fosfor nanosheets
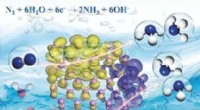
- Plastic transparanter maken en tegelijkertijd elektrische geleidbaarheid toevoegen

- Peptiden die als pil kunnen worden ingenomen
- De toekomst van biobrandstoffen in het donker

- In lijn:het eenvoudige ontwerp en de controle van MOF elektrische stroom

 Hoeveel ionen aanwezig in NaCl -oplossing?
Hoeveel ionen aanwezig in NaCl -oplossing?  Abonneren op YouTube TV? U kunt NBC-kanalen kwijtraken in een vervoersgeschil
Abonneren op YouTube TV? U kunt NBC-kanalen kwijtraken in een vervoersgeschil Samsungs huishoudhulp in de vorm van een bal en rolde naar CES
Samsungs huishoudhulp in de vorm van een bal en rolde naar CES Oppervlakteprocessen Vind je het meest voorkomen in het zonnestelsel?
Oppervlakteprocessen Vind je het meest voorkomen in het zonnestelsel?  Wat is het resultaat van de afbuiging geladen deeltjes langs Van Allen -riemen?
Wat is het resultaat van de afbuiging geladen deeltjes langs Van Allen -riemen?  Als werk je religie wordt, doet niets anders ertoe
Als werk je religie wordt, doet niets anders ertoe De algehele impact van Harvey verkleint latere stormen, Texas Flood Registry vindt
De algehele impact van Harvey verkleint latere stormen, Texas Flood Registry vindt Wanneer is een object in stralingsbalans?
Wanneer is een object in stralingsbalans?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

