
Wetenschap
Hoe deeltjes veranderen als ze van gas tot vloeistof vermelden?
Gasstatus
* afstand: Deeltjes zijn wijd verdeeld en hebben zeer weinig interactie met elkaar.
* Beweging: Deeltjes bewegen snel en willekeurig in alle richtingen.
* Kinetische energie: Deeltjes bezitten een hoog niveau van kinetische energie (beweging van beweging).
* Structuur: Geen vaste vorm of volume. Gassen breiden zich uit om hun containers te vullen.
vloeibare toestand
* afstand: Deeltjes zijn dichter bij elkaar dan in de gasvormige toestand.
* Beweging: Deeltjes bewegen langzamer en hebben meer interacties met elkaar.
* Kinetische energie: Deeltjes hebben minder kinetische energie dan in de gasvormige toestand.
* Structuur: Vloeistoffen hebben een duidelijk volume maar nemen de vorm van hun container.
De overgang (condensatie)
1. Koeling: Terwijl een gas wordt afgekoeld, verliezen de deeltjes kinetische energie. Ze vertragen en komen dichter bij elkaar.
2. Aantrekkelijke krachten: Door de dichter nabijheid kunnen de aantrekkelijke krachten tussen deeltjes belangrijker worden. Deze krachten, zoals waterstofbinding, dipool-dipoolinteracties of Londense dispersiekrachten, trekken deeltjes naar elkaar toe.
3. Verminderde beweging: De balans tussen kinetische energie en aantrekkelijke krachten verschuift. De deeltjes worden meer beperkt en hun beweging wordt beperkt.
4. Vorming van een vloeistof: Naarmate meer deeltjes condenseren, ontstaat een vloeibare fase. De deeltjes zijn nog steeds in constante beweging, maar hun beweging is beperkt en gecoördineerd dan in de gasvormige toestand.
Key Points
* Energieverandering: De overgang van gas naar vloeistof is een exotherme proces, wat betekent dat warmte wordt vrijgegeven. De verloren kinetische energie wordt overgebracht naar de omgeving.
* intermoleculaire krachten: De sterkte van intermoleculaire krachten tussen deeltjes speelt een cruciale rol bij het bepalen van het condensatiepunt van een gas.
* omkeerbaarheid: Het proces kan worden omgekeerd door warmte (toenemende kinetische energie) aan de vloeistof toe te voegen, waardoor het verdampt en terugkeert naar de gasvormige toestand.
 Eindelijk, het antwoord op een brandende vraag van 40 jaar
Eindelijk, het antwoord op een brandende vraag van 40 jaar Hoe kan de reactie met zuurstof worden gebruikt om een metaal van niet-metaal te onderscheiden?
Hoe kan de reactie met zuurstof worden gebruikt om een metaal van niet-metaal te onderscheiden?  Levensechte scheikunde gemaakt in laboratoriumonderzoek naar manieren om de oorsprong van het leven te bestuderen
Levensechte scheikunde gemaakt in laboratoriumonderzoek naar manieren om de oorsprong van het leven te bestuderen De snelheid waarmee een stof warmte geleidt?
De snelheid waarmee een stof warmte geleidt?  Kenmerken van waterstofbinding
Kenmerken van waterstofbinding
Hoofdlijnen
- Hoe het brein van een vleermuis navigeert
- Wat testen wetenschappers?
- Waarom is belangrijk voor het wortel- en schietsysteem van planten om samen te werken?
- Hoe worden protisten geclassificeerd?
- Hoe marketinglessen kunnen voorkomen dat 'lelijke producten' voedselverspilling worden
- Wat is het doel van ribosomen?
- Wat zijn Palade -deeltjes en waarom ze dat hebben gebeld?
- Waarom bestuderen wetenschappers ASMR meer?
- Hoe worden cellen die recombinant DNA bevatten geselecteerd?
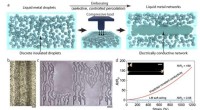
- Zelfherstellende elastomeren van vloeibaar metaal
- Natuurkundigen maken stop-actiebeelden van door licht aangestuurde moleculaire reactie

- Flexibele vaste elektrolyten voor all-solid-state lithiumbatterijen

- Water ruilen voor CO2 kan fracken groener en effectiever maken

- Veelzijdige ontwerpoptimalisatie voor superomnifobe oppervlakken

 Toekomstige gevolgen van El Nino, La Nina zal waarschijnlijk intensiveren
Toekomstige gevolgen van El Nino, La Nina zal waarschijnlijk intensiveren Waarom worden rotsen mengsels genoemd?
Waarom worden rotsen mengsels genoemd?  Wereldrecords voor dagelijkse temperaturen zijn verbroken:zo weten we het
Wereldrecords voor dagelijkse temperaturen zijn verbroken:zo weten we het  Waarom is het op zonne -energie moeilijk te benutten?
Waarom is het op zonne -energie moeilijk te benutten?  Welke wolken zijn hoger dan cirruswolken?
Welke wolken zijn hoger dan cirruswolken?  Problemen met het 3-lichaamsprobleem? Experts bespreken natuurkunde en wiskunde achter de populaire Netflix-show
Problemen met het 3-lichaamsprobleem? Experts bespreken natuurkunde en wiskunde achter de populaire Netflix-show  Getextureerde stofstormen op Mars
Getextureerde stofstormen op Mars Wat is zuurverwering?
Wat is zuurverwering?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

