
Wetenschap
Als je twee stoffen hebt die dezelfde grootte en vergelijkbare dichtheden hebben, hoe dan ook, dan zouden ze ze verschillende kookpunten scheiden?
Het proces van destillatie:
1. Verwarming: Het mengsel van stoffen wordt verwarmd.
2. verdamping: De stof met het onderste kookpunt zal eerst verdampen (in een gas veranderen).
3. Condensatie: De damp wordt vervolgens afgekoeld, waardoor hij zich terug in een vloeistof condenseert.
4. Collectie: De gecondenseerde vloeistof (de stof met het onderste kookpunt) wordt afzonderlijk verzameld.
5. Herhaal: Dit proces kan worden herhaald om de stoffen verder te scheiden, vooral als hun kookpunten dicht bij elkaar zijn.
Waarom dit werkt:
* kookpunt: Elke stof heeft een specifieke temperatuur waarbij deze van een vloeistof in een gas verandert. De stof met het onderste kookpunt zal eerst verdampen.
* dampdruk: De dampdruk van een stof is de druk die de damp uitoefent in evenwicht met zijn vloeibare fase. De stof met het onderste kookpunt heeft een hogere dampdruk bij een gegeven temperatuur, waardoor het gemakkelijker is om te verdampen.
Voorbeeld:
Denk aan het scheiden van water (kookpunt 100 ° C) en ethanol (kookpunt 78 ° C). Je zou het mengsel kunnen verwarmen totdat het ethanol verdampt, waardoor het water achterblijft. De ethanoldamp kan vervolgens worden verzameld door het te koelen.
Sleutelpunten:
* Vergelijkbare dichtheden: Het verschil in dichtheden speelt geen belangrijke rol in destillatie.
* Dezelfde maat: De grootte van de moleculen doet er niet zoveel toe als hun kookpunten.
* fractionele destillatie: Voor stoffen met zeer hechte kookpunten wordt een meer complexe methode genaamd fractionele destillatie gebruikt. Deze methode omvat het gebruik van een kolom met veel oppervlakken om meer mogelijkheden te bieden voor verdamping en condensatie.
Laat het me weten als je een van deze concepten in meer detail wilt verkennen!
 Wat is de lading van een oxide -ion?
Wat is de lading van een oxide -ion?  Uit onderzoek blijkt waarom de luchtvervuiling in het oosten van de VS in de winter meer stagneert
Uit onderzoek blijkt waarom de luchtvervuiling in het oosten van de VS in de winter meer stagneert  Lijst van recycleerbare aluminium blikjes
Lijst van recycleerbare aluminium blikjes Wat kan worden opgesplitst in eenvoudigere stoffen door chemische, maar niet fysiek middel?
Wat kan worden opgesplitst in eenvoudigere stoffen door chemische, maar niet fysiek middel?  Hoeveel elektronen heeft zwavel-33?
Hoeveel elektronen heeft zwavel-33?
Hoofdlijnen
- Hoe neemt een slijmvorm beslissingen zonder hersenen?
- Onderzoekers identificeren hoe koninginnen de vruchtbaarheid van werknemers onderdrukken
- Wetenschappers ontdekken hoe cellen reageren op vasten
- Wat is de rol van bemesting?
- Wat het soort vragen dat niet door de wetenschap kan worden beantwoord?
- Hoe is een cel levend wezen dat kern heeft geroepen?
- Hoe Nigeria zijn enorme cashew-afval kan omzetten in waardevol citroenzuur
- Maak een lijst van de soorten organismen waarmee energie doorloopt in een ecosysteem?
- Welke andere dieren delen dezelfde omgeving met ToCo Toucans?
- Kwikzilver inhalen:MXene-materiaal kan kwikverontreiniging tegengaan

- Het ontdekken van elektrokatalysatoren versnellen met machine learning

- Nieuwe techniek voor het bestuderen van roesten van staal komt de mijnbouwsector ten goede

- Een organokatalysator gebruiken om de polymerisatie te stereocontroleren
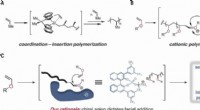
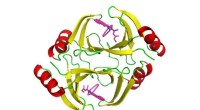
- Studie biedt nieuwe aanwijzingen voor het verbeteren van chemotherapie
 Ambassadeur VS keert terug naar Italië, standbeeld gestolen in 1968
Ambassadeur VS keert terug naar Italië, standbeeld gestolen in 1968 Afbeelding:Het krimpende water van het Tsjaadmeer
Afbeelding:Het krimpende water van het Tsjaadmeer Drie hoofdelementen die deel uitmaken van levende wezens?
Drie hoofdelementen die deel uitmaken van levende wezens?  Beschrijf het DNA -model dat je hebt geconstrueerd?
Beschrijf het DNA -model dat je hebt geconstrueerd?  Hoe en waarom NASA elke plek op Mars een naam geeft
Hoe en waarom NASA elke plek op Mars een naam geeft  Infrarood versus Zichtbaar licht
Infrarood versus Zichtbaar licht  Is glas smelten een chemische verandering?
Is glas smelten een chemische verandering?  Opgeslikt, verscheurd of voortlevend:hoe het met de aarde zal gaan als de zon sterft
Opgeslikt, verscheurd of voortlevend:hoe het met de aarde zal gaan als de zon sterft
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

