
Wetenschap
In termen van kinetische moleculaire theorie -gassen, hoe kan de temperatuur toenemen een gasgebonden rigide container een drukgas veroorzaken?
Kinetische moleculaire theorie Basics
* Gasdeeltjes zijn constant, willekeurige beweging: Ze bewegen in rechte lijnen totdat ze met elkaar of de containerwanden botsen.
* botsingen zijn volkomen elastisch: Energie wordt overgedragen tijdens botsingen, maar er gaat geen energie verloren.
* verwaarloosbaar volume deeltjes: Het volume van de gasdeeltjes zelf is klein in vergelijking met het volume van de container.
* Geen aantrekkelijke of afstotende krachten: Gasdeeltjes interageren niet met elkaar behalve tijdens botsingen.
hoe temperatuur de druk beïnvloedt
1. Verhoogde kinetische energie: Wanneer u de temperatuur van een gas verhoogt, voegt u energie toe aan zijn deeltjes. Deze energie manifesteert zich als verhoogde kinetische energie , wat betekent dat de deeltjes sneller bewegen.
2. Vaker en krachtige botsingen: Naarmate de gasdeeltjes sneller bewegen, botsen ze vaker met de wanden van de container en met een grotere kracht.
3. Druk neemt toe: Druk wordt gedefinieerd terwijl de kracht wordt uitgeoefend per oppervlakte -eenheid. Omdat de botsingen frequenter en krachtiger zijn, neemt de kracht op de containerwanden toe, wat leidt tot een toename van de druk.
Key Points
* rigide container: De container is rigide is cruciaal. Als de container zou kunnen uitbreiden, zou de verhoogde druk dit doen, waardoor een relatief constante interne druk wordt gehandhaafd.
* constant volume: Het volume van het gas blijft constant omdat de container niet kan uitbreiden. Dit betekent dat de verhoogde kinetische energie zich direct vertaalt in een toename van de druk.
Samenvattend
Het verhogen van de temperatuur van een gas dat is beperkt in een rigide container leidt tot een toename van de druk omdat de gasdeeltjes sneller bewegen, wat resulteert in frequentere en krachtige botsingen met de containerwanden.
 Nieuwe herbruikbare en recyclebare milieuvriendelijke hydrogel
Nieuwe herbruikbare en recyclebare milieuvriendelijke hydrogel  Deeltjes ontsnappen uit het oppervlak van een niet -kokende vloeistof en komen de gastoestand binnen?
Deeltjes ontsnappen uit het oppervlak van een niet -kokende vloeistof en komen de gastoestand binnen?  Welke van de moleculen die in de vergelijkingen worden weergegeven, is een samengestelde verbinding?
Welke van de moleculen die in de vergelijkingen worden weergegeven, is een samengestelde verbinding?  De temperatuur waarbij de dampdruk in vloeistof gelijk is aan extern werk op oppervlak A?
De temperatuur waarbij de dampdruk in vloeistof gelijk is aan extern werk op oppervlak A?  Wat is de verhouding van stikstofatomen N tot zuurstof O in een verbinding met formule N2O5 hetzelfde als NO2?
Wat is de verhouding van stikstofatomen N tot zuurstof O in een verbinding met formule N2O5 hetzelfde als NO2?
 Nieuw onderzoek laat zien hoe 'groene eilanden' bossen helpen regenereren na brand
Nieuw onderzoek laat zien hoe 'groene eilanden' bossen helpen regenereren na brand  Waterkrachtdammen kunnen worden beheerd zonder een alles-of-niets-keuze tussen energie en voedsel
Waterkrachtdammen kunnen worden beheerd zonder een alles-of-niets-keuze tussen energie en voedsel Planten in de Noordpool
Planten in de Noordpool Nieuwe studie toont voordelen van ondergewaardeerde kwelder aan
Nieuwe studie toont voordelen van ondergewaardeerde kwelder aan Leg de rol van bos uit bij het handhaven van de balans tussen zuurstof- en koolstofdioxide -atmosfeer?
Leg de rol van bos uit bij het handhaven van de balans tussen zuurstof- en koolstofdioxide -atmosfeer?
Hoofdlijnen
- Indringende vraag:Wat is zaadbankieren?
- Wat zijn twee detritivoren van het Taiga Biome?
- Hoe fluctuerende zuurstofniveaus de evolutie van dieren kunnen hebben versneld
- Hoe slaap werkt
- Wat is de samenstelling van biosfeer?
- Waarom heeft DNA 2 verschillende maten groeven?
- Wat is het doel van anxiolytica?
- Natuurlijke selectie werkt op variatie door?
- Waarvoor staan de en staan voor in griepvirussen?
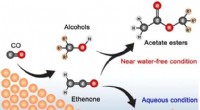
- Duurzame elektrosynthese van esters
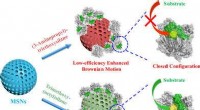
- Enzymconformatie beïnvloedt de prestaties van lipase-aangedreven nanomotoren
- Onderzoekers ontdekken nieuwe techniek om te testen op virale infecties

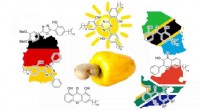
- Groene chemici vinden een manier om cashewnootdoppen om te zetten in zonnebrandcrème
- Nieuw ontwikkeld materiaal kan leiden tot lichtere, veiliger auto-ontwerpen

 Wat zijn de banden van verschillende gekleurde of gestructureerde materialen in sommige sedimentaire rotsen die worden genoemd?
Wat zijn de banden van verschillende gekleurde of gestructureerde materialen in sommige sedimentaire rotsen die worden genoemd?  Waarom gaan kleine sterren langer mee dan grote?
Waarom gaan kleine sterren langer mee dan grote?  Het nieuwe composiet voorkomt storingen van elektronische apparaten
Het nieuwe composiet voorkomt storingen van elektronische apparaten Het effect van alcohol op planten
Het effect van alcohol op planten Hoe wetenschappers over de hele wereld de zonnecyclus volgen
Hoe wetenschappers over de hele wereld de zonnecyclus volgen  Machine learning versnellen door middel van licht
Machine learning versnellen door middel van licht Wat is thermisch energieverlies?
Wat is thermisch energieverlies?  Wat is het kookpunt van R-410A-refigerent?
Wat is het kookpunt van R-410A-refigerent?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

