
Wetenschap
Wat is het effect van het plaatsen van elektronen die heel dicht bij het proton zijn?
1. Sterke elektrostatische aantrekkingskracht:
Het primaire effect is een zeer sterke elektrostatische aantrekkingskracht tussen het negatief geladen elektron en het positief geladen proton. Deze kracht wordt beheerst door de wet van Coulomb, en omdat de afstand tussen hen erg klein is, wordt de kracht ongelooflijk groot.
2. Vorming van een waterstofatoom:
Deze sterke aantrekkingskracht is de fundamentele reden waarom elektronen en protonen samenbinden om een waterstofatoom te vormen. Het elektron beslaat een orbitaal rond het proton, constant in beweging vanwege de balans tussen zijn kinetische energie en de elektrostatische potentiële energie.
3. Kwantummechanische effecten:
Op zulke kleine afstanden worden kwantummechanische effecten zeer significant. Het gedrag van het elektron wordt niet langer nauwkeurig beschreven door de klassieke fysica. In plaats daarvan bestaat het in een waarschijnlijkheidswolk, beschreven door de golffunctie van het atoom.
4. Energieniveaus:
Het elektron in een waterstofatoom kan alleen specifieke energieniveaus bezetten, die worden gekwantiseerd. Naarmate het elektron dichter bij het proton komt, bezet het lagere energieniveaus. Deze energieniveaus zijn discreet, wat betekent dat het elektron geen energieën tussen hen kan bezetten.
5. Emissie en absorptie van licht:
Wanneer het elektron tussen energieniveaus springt, absorbeert of stoot het lichte fotonen met specifieke frequenties uit. Dit is de basis van atomaire spectroscopie, waardoor we de structuur van atomen kunnen bestuderen.
6. Chemische binding:
De sterke aantrekkingskracht tussen elektronen en protonen is ook de basis van chemische binding. Wanneer atomen elektronen delen, vormen ze moleculen en structuren met specifieke eigenschappen.
7. Ionisatie:
Als er voldoende energie aan het elektron wordt geleverd, kan dit de elektrostatische aantrekkingskracht overwinnen en volledig uit het atoom worden verwijderd, waardoor een positief geladen ion achterblijft. Dit proces wordt ionisatie genoemd.
8. Instabiliteit op extreem korte afstanden:
Hoewel een sterke aantrekkingskracht op nauwe afstanden bestaat, zou het zeer onstabiel zijn om een elektron ongelooflijk dicht bij het proton te brengen (veel dichterbij dan de typische atomaire straal). Dit komt omdat de afstotingskracht tussen het elektron en de samenstellende quarks van het proton uiteindelijk zou domineren over de elektrostatische aantrekkingskracht.
Samenvattend: Het plaatsen van een elektron zeer dicht bij een proton resulteert in een sterke elektrostatische aantrekkingskracht, wat leidt tot de vorming van een waterstofatoom met gekwantiseerde energieniveaus en de mogelijkheid van lichtemissie of absorptie. Door ze echter extreem dichtbij te brengen, zou echter leiden tot instabiliteit vanwege de dominante kracht van afstoting tussen de fundamentele deeltjes.
 Nieuw onderzoek naar de risico's van blootstelling aan lood door kogels die worden gebruikt bij de jacht op groot wild
Nieuw onderzoek naar de risico's van blootstelling aan lood door kogels die worden gebruikt bij de jacht op groot wild Hoe kunnen de oplosbaarheidsregels helpen het product van een reactie te voorspellen?
Hoe kunnen de oplosbaarheidsregels helpen het product van een reactie te voorspellen?  Wat is de Lewis Dot -structuur voor natriumhydroxide?
Wat is de Lewis Dot -structuur voor natriumhydroxide?  Wat gebeurt er als een stof rechtstreeks van vaste toestand naar gas gaat als droogijs?
Wat gebeurt er als een stof rechtstreeks van vaste toestand naar gas gaat als droogijs?  Wat is de pH van stikstofoxide?
Wat is de pH van stikstofoxide?
 Beving met een kracht van 6,9 op de schaal van Richter treft Papoea-Nieuw-Guinea
Beving met een kracht van 6,9 op de schaal van Richter treft Papoea-Nieuw-Guinea Langst bekende ononderbroken registratie van het Paleozoïcum ontdekt in de wildernis van Yukon
Langst bekende ononderbroken registratie van het Paleozoïcum ontdekt in de wildernis van Yukon Hoe beïnvloedt de omgeving een overleving van een soort?
Hoe beïnvloedt de omgeving een overleving van een soort?  Betere neerslagvoorspellingen tot enkele uren van tevoren
Betere neerslagvoorspellingen tot enkele uren van tevoren Wat zijn de kenmerken van de kunstmatige omgeving?
Wat zijn de kenmerken van de kunstmatige omgeving?
Hoofdlijnen
- De (blanco) gevonden in de nucleaire envelop zijn bekleed met gespecialiseerde eiwitten die het transport van stoffen in en uit de kern mogelijk maken?
- Acht nieuwe soorten kleine gekko's tuimelen uit de regenwouden van Madagaskar
- Hoe een bescheiden paddenstoel bossen kan redden en klimaatverandering kan bestrijden
- Waarom is genetische diversiteit zo belangrijk voor levende dingen?
- Onderzoek laat zien hoe verschillen in mannelijke en vrouwelijke hersenen ontstaan
- Wat zijn KMEF -eiwitten?
- Wetenschapsprojecten: roken en de gevolgen ervan op de longen
- Hoe verhouden de termen organisch en anorganisch zich tot biotische abiotische componenten van een ecosysteem?
- Organel die calicium opslaat in rustende skeletspiervezels?
- De vijfhoek en de boon - de structuur van een eiwit van het immuunsysteem opnieuw tekenen

- Onderzoekers ontdekken proces om psilocybine duurzaam te produceren een kandidaat-geneesmiddel dat kan helpen bij de behandeling van depressie

- Vervaardiging van filter met afvalmaïsstro voor efficiënte fosfaatverwijdering

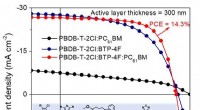
- Meer dan 14% efficiëntie voor ternaire organische zonnecel met 300 nm dikke actieve laag
- Onderzoek toont aan dat afzonderlijke atomen efficiëntere katalysatoren kunnen maken

 Welke staat ontvangt de regenval als gevolg van westerse ongeregeldheden?
Welke staat ontvangt de regenval als gevolg van westerse ongeregeldheden?  Gebruik maken van geluid voor de gezondheid
Gebruik maken van geluid voor de gezondheid Machine learning kraakt de oxidatietoestanden van kristalstructuren
Machine learning kraakt de oxidatietoestanden van kristalstructuren Snelle feiten over de Boeing 737 MAX 8
Snelle feiten over de Boeing 737 MAX 8  Heeft u haast met het ontwikkelen van medicijnen? Hier is je chat
Heeft u haast met het ontwikkelen van medicijnen? Hier is je chat  Energie kan door lege ruimte worden overgedragen door wat?
Energie kan door lege ruimte worden overgedragen door wat?  Welke planten en dieren leven op het grondniveau van het regenwoud?
Welke planten en dieren leven op het grondniveau van het regenwoud?  Waterstofbrandstofcellen combineren waterstof en zuurstof om water te produceren, neem aan dat 1 kg wordt gebruikt de massa geproduceerd 1,10 x 10-11 Hoeveel door deze brandstof?
Waterstofbrandstofcellen combineren waterstof en zuurstof om water te produceren, neem aan dat 1 kg wordt gebruikt de massa geproduceerd 1,10 x 10-11 Hoeveel door deze brandstof?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

