
Wetenschap
Hoeveel NH3 is er nodig om precies te reageren met 21 gram CH3OH?
1. Schrijf de gebalanceerde chemische vergelijking:
De reactie tussen methanol (CH3OH) en ammoniak (NH3) produceert methylamine (CH3NH2) en water (H2O).
CH3OH + NH3 → CH3NH2 + H2O
2. Bereken de molaire massa van elke reactant:
* CH3OH (methanol):12.01 g/mol (c) + 4,03 g/mol (H) + 16,00 g/mol (O) =32,04 g/mol
* NH3 (ammoniak):14.01 g/mol (n) + 3,02 g/mol (H) =17,03 g/mol
3. Converteer de massa methanol in mollen:
* Mol CH3OH =(massa van CH3OH) / (Molaire massa van CH3OH)
* Mol CH3OH =21 g / 32.04 g / mol =0,655 mol
4. Bepaal de molverhouding van de gebalanceerde vergelijking:
* De gebalanceerde vergelijking toont een 1:1 molverhouding tussen CH3OH en NH3. Dit betekent dat je voor elke 1 mol CH3OH 1 mol NH3 nodig hebt.
5. Bereken de mol NH3 die nodig is:
* Aangezien de molverhouding 1:1 is, hebt u 0,655 mol NH3 nodig.
6. Converteer de mol NH3 naar gram:
* Massa van NH3 =(mol NH3) * (molaire massa van NH3)
* Massa van NH3 =0,655 mol * 17,03 g/mol =11,15 g
Daarom heeft u ongeveer 11,15 gram NH3 nodig om precies te reageren met 21 gram CH3OH.
 Overgangsmetaalvrije koolstof-koolstofbindingsvormende reactie:vinylering van azaallyls
Overgangsmetaalvrije koolstof-koolstofbindingsvormende reactie:vinylering van azaallyls Switch-in-a-cell elektriseert het leven
Switch-in-a-cell elektriseert het leven Hoe producten een symbolische betekenis te geven
Hoe producten een symbolische betekenis te geven  Waarom leidt gesmolten natriumhydride elektriciteit?
Waarom leidt gesmolten natriumhydride elektriciteit?  Als een katalysator bij evenwicht wordt toegevoegd aan het systeem en de temperatuurdruk constant blijft, is er geen effect op de?
Als een katalysator bij evenwicht wordt toegevoegd aan het systeem en de temperatuurdruk constant blijft, is er geen effect op de?
 Gletsjer nieuwste Amerikaanse park wordt verschroeid door westerse bosbranden
Gletsjer nieuwste Amerikaanse park wordt verschroeid door westerse bosbranden Heeft geweld onze gezichten gevormd?
Heeft geweld onze gezichten gevormd?  Heeft adaptieve straling de evolutie van reptielen bepaald?
Heeft adaptieve straling de evolutie van reptielen bepaald?  Extreem weer meemaken is niet genoeg om klimaatkanssceptici te overtuigen
Extreem weer meemaken is niet genoeg om klimaatkanssceptici te overtuigen Lijst van natuurlijke rijkdommen van de staat New Jersey
Lijst van natuurlijke rijkdommen van de staat New Jersey
Hoofdlijnen
- Hoe bestrijden planten ziekten?
- Waar bevinden zich delen van het chloroplast-ATP-synthase die betrokken zijn bij de fosforylering van ADP naar ATP?
- Studie werpt nieuw licht op hoe dieren en planten reageren op veranderingen in de omgeving
- Wat is een dier dat zich voedt met de lichamen van dode organismen?
- Een bepaalde genenpool bevat slechts twee allelen G en H voor een erfelijke eigenschap als allel een relatieve frequentie van 42 procent heeft Wat is de H?
- Welk deel van de plantencel geeft het vorm en ondersteuning?
- Wat is Agarobiose?
- Voorheen onbekende dinosaurussoort geïdentificeerd in het zuidwesten van Duitsland
- Fossiele of anorganische structuur? Wetenschappers verdiepen zich in vroege levensvormen
- Kirigami kan terahertz-stralen in realtime ronddraaien om in biologisch weefsel te kijken

- Nieuwe technologie om de hoge permselectiviteit en anti-biofouling eigenschappen van RO-membranen te verbeteren
- Nieuwe sonde met superresolutie legt cellen in ongekend detail vast
- Palladiumkatalysator versnelt twee afzonderlijke reacties, bruikbare moleculen maken in één proces
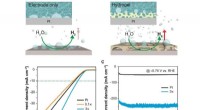
- Superaerofobe hydrogels voor verbeterde elektrochemische en foto-elektrochemische waterstofproductie
 Klimaatverandering dwingt Alaskanen op zoek te gaan naar nieuwe manieren om te overleven
Klimaatverandering dwingt Alaskanen op zoek te gaan naar nieuwe manieren om te overleven Hoe een magneet te boren
Hoe een magneet te boren  Is het vormen van een conclusie wetenschappelijke methode?
Is het vormen van een conclusie wetenschappelijke methode?  Welke seismische golf wordt gevonden op het oppervlak van de aarde?
Welke seismische golf wordt gevonden op het oppervlak van de aarde?  Contact houden:waarom bedrijven relaties onderhouden met voormalige werknemers
Contact houden:waarom bedrijven relaties onderhouden met voormalige werknemers  Maakt de zwaartekracht deel uit van een geologisch proces?
Maakt de zwaartekracht deel uit van een geologisch proces?  Hoe schrijf je 194 x 103 in wetenschappelijke notatie?
Hoe schrijf je 194 x 103 in wetenschappelijke notatie?  Is er een verband tussen religie en wetenschap?
Is er een verband tussen religie en wetenschap?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

