
Wetenschap
Wat heeft elektronafscherming te maken met smeltpunten?
Inzicht in elektronenscherming
Elektronenafscherming verwijst naar de vermindering van de aantrekkelijke kracht tussen de kern en een buitenste elektron vanwege de aanwezigheid van binnenste elektronen. Binnen -elektronen werken als een schild, het afstoten van de buitenste elektronen en waardoor ze minder strak gebonden zijn aan de kern.
impact op smeltpunten
* Verhoogd afscherming, lager smeltpunt:
- Wanneer elektronenscherming sterk is, worden buitenste elektronen minder strak gehouden, wat resulteert in zwakkere interatomische krachten (zoals metalen bindingen of van der Waals -krachten).
- Zwakkere interatomische krachten betekent dat er minder energie nodig is om de bindingen en de overgang van vaste naar vloeistof te doorbreken. Dit leidt tot lagere smeltpunten.
* verlaagd afscherming, hoger smeltpunt:
- Omgekeerd, wanneer elektronenscherming zwak is, worden buitenste elektronen sterk aangetrokken tot de kern. Dit leidt tot sterkere interatomische krachten en een hoger smeltpunt.
Voorbeeld:elementen in dezelfde groep
Beschouw de alkali -metalen (groep 1) terwijl u de periodieke tabel naar beneden gaat:
* lithium (li): Heeft weinig binnenste elektronen, dus afscherming is zwak. Buitenste elektronen worden strak vastgehouden, wat leidt tot een relatief hoog smeltpunt.
* natrium (NA): Heeft meer innerlijke elektronen, toenemende afscherming. Buitenste elektronen worden minder strak vastgehouden, wat resulteert in een lager smeltpunt dan lithium.
* kalium (k): Nog meer afscherming, wat leidt tot een nog lager smeltpunt.
Andere factoren die van invloed zijn op het smeltpunt
Terwijl elektronenscherming een belangrijke rol speelt, dragen andere factoren ook bij aan smeltpunten:
* Atomaire maat: Grotere atomen hebben een grotere afstand tussen de kern en de buitenste elektronen, wat leidt tot zwakkere aantrekkingskracht en lagere smeltpunten.
* Aantal valentie -elektronen: Elementen met meer valentie -elektronen hebben meestal sterkere interatomische bindingen en hogere smeltpunten.
* kristalstructuur: Verschillende kristalstructuren hebben verschillende sterke punten, die smeltpunten beïnvloeden.
Conclusie
Elektronenafscherming is een cruciale factor bij het bepalen van smeltpunten, omdat het de sterkte van interatomische krachten beïnvloedt. Door te begrijpen hoe afscherming elektroneninteracties beïnvloedt, kunnen we de trends van het smeltpunt beter voorspellen en verklaren in verschillende elementen en verbindingen.
 Nieuw onderzoek geeft een betere kijk op de oceaanplaat onder Midden-Amerika
Nieuw onderzoek geeft een betere kijk op de oceaanplaat onder Midden-Amerika Wat zijn de top 5 natuurlijke hulpbronnen?
Wat zijn de top 5 natuurlijke hulpbronnen?  Geef een voorbeeld van niet-levend ding dat twee kenmerken levende dingen geeft?
Geef een voorbeeld van niet-levend ding dat twee kenmerken levende dingen geeft?  Wetenschapper leidt aanstaande NASA-veldstudie van sneeuwstormen aan de oostkust
Wetenschapper leidt aanstaande NASA-veldstudie van sneeuwstormen aan de oostkust Hoe reageren woestijnplanten op variaties in stikstof en water in droge gebieden?
Hoe reageren woestijnplanten op variaties in stikstof en water in droge gebieden?
Hoofdlijnen
- Welk enzym breekt eiwitten af?
- Eiwittrekken - Leren hoe eiwitten zich daardoor uit elkaar vouwen
- Hoe jagen spinnen 'in koor'?
- Middelgrote carnivoren lopen het grootste risico door veranderingen in het milieu
- Is een groot stuk grasplant dier algen -schimmel?
- Waarom het mitochondriale genoom van sla lijkt op een gehakte salade
- Kan een klein deeltje de plaag van het vergroenen van citrusvruchten tegengaan?
- Biologen ontdekken hoe een kankerverwekkend virus de reactie van het immuunsysteem vermijdt
- Wat zijn drie manieren waarop soorten zich kunnen verspreiden?
- Op bladeren geïnspireerd oppervlak voorkomt vorstvorming

- Betere bètapeptiden bouwen

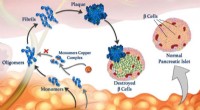
- Koperionen kunnen een sleutelrol spelen wanneer het vouwen van peptiden fout gaat
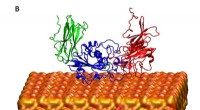
- XSEDE-supercomputertoewijzingen op Stampede1 en Comet helpen bij het vouwen van eiwitten in onderzoek naar botregeneratie
- Stof maken van hout

 Smooth ER heeft verschillende functies, waaronder regulerende niveaus in spierafwijking van toxines levercellen en het maken van membraanlipiden?
Smooth ER heeft verschillende functies, waaronder regulerende niveaus in spierafwijking van toxines levercellen en het maken van membraanlipiden?  Koolstofemissies van vulkanisch gesteente kunnen leiden tot opwarming van de aarde:studie
Koolstofemissies van vulkanisch gesteente kunnen leiden tot opwarming van de aarde:studie Zullen eerdere bronnen de natuur uit de pas lopen?
Zullen eerdere bronnen de natuur uit de pas lopen?  Welke gebieden in het DNA bevatten herhaalde segmenten?
Welke gebieden in het DNA bevatten herhaalde segmenten?  Video:Hoe werkt Adderall?
Video:Hoe werkt Adderall?  Hoe identificeer je de relatieve massa -relaitieve lading en locatie van drie kleiner subatomair deeltje een atoom?
Hoe identificeer je de relatieve massa -relaitieve lading en locatie van drie kleiner subatomair deeltje een atoom?  Is een vliegtuig in vluchtobject met kinetische energie?
Is een vliegtuig in vluchtobject met kinetische energie?  Wat is diploïde eukaryotisch?
Wat is diploïde eukaryotisch?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

