
Wetenschap
De kleur van het licht dat wordt uitgezonden door een atoom is het meest verwant?
* Elektronenergieniveaus: Elektronen in een atoom bestaan in specifieke energieniveaus. Deze niveaus zijn gekwantiseerd, wat betekent dat ze alleen specifieke, afzonderlijke hoeveelheden energie kunnen bevatten.
* excitatie: Wanneer een atoom energie absorbeert (van warmte, licht of andere bronnen), kan een elektron naar een hoger energieniveau springen. Dit wordt excitatie genoemd.
* De-excitatie: Het opgewonden elektron is onstabiel en wil terugkeren naar zijn grondtoestand (laagste energieniveau). Om dit te doen, geeft het de overtollige energie vrij als een foton van licht.
* Fotonenergie en kleur: Het energieverschil tussen de opgewonden toestand en de grondtoestand bepaalt de energie van het uitgezonden foton. Omdat de energie van een foton direct gerelateerd is aan zijn kleur (hogere energie =kortere golflengte =bluer kleur), bepaalt het energieverschil tussen elektronenniveaus de kleur van het uitgestoten licht.
Samenvattend: De specifieke energieniveaus binnen een atoom bepalen de energieverschillen die elektronen kunnen ondergaan, en die energieverschillen bepalen de kleur van het licht dat wordt uitgestoten wanneer een opgewonden elektron terugkeert naar zijn grondtoestand.
 Nieuwe satelliettechnologie biedt een meer gedetailleerde kaart van bewegende Antarctische gletsjers
Nieuwe satelliettechnologie biedt een meer gedetailleerde kaart van bewegende Antarctische gletsjers Nieuwe 3D-modellen laten zien hoe het opwarmende klimaat de getijden onder water beïnvloedt
Nieuwe 3D-modellen laten zien hoe het opwarmende klimaat de getijden onder water beïnvloedt  Wat is ecologische zonde?
Wat is ecologische zonde?  Verwoestende bosbranden rukken op door Noord-Californië
Verwoestende bosbranden rukken op door Noord-Californië NASA vindt tropische storm Saola's kracht uit het midden
NASA vindt tropische storm Saola's kracht uit het midden
Hoofdlijnen
- Welke invloed heeft veroudering op de mogelijkheid om homeostase te herstellen?
- Hoe heeft Mary -uitvinding bijgedragen aan de wetenschap?
- Wie identificeerde de natuurlijke selectie als een component van evolutie?
- Wat zijn enkele kenmerken van DNA?
- Mendels Experimenten: The Study of Pea Plants & Inheritance
- Wat is het verschil tussen een positieve en een negatieve reactie in de biologie?
- Wat zijn enkele bioluminescente dieren?
- De verbazingwekkende efficiëntie van het leven
- Onderzoek toont aan waarom verdoving de wandelaars van cellen tegenhoudt
- Onderzoek naar betere biotransformaties

- Onderzoekers ontrafelen de actieve fase in katalytische reductie van kooldioxide tot methanol
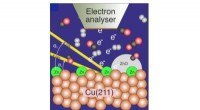
- Onderzoekers ontwerpen afstembare, zelfherstellende kleurstoffen voor gebruik in slimme apparaten van de volgende generatie

- Oostenrijkse onderzoekers vergemakkelijken de analyse van lipidegegevens
- Technologie voor het produceren van aluminium matrixcomposieten uit nieuwe grondstoffen

 Jurassic Park:waarom we dertig jaar later nog steeds moeite hebben om dit te realiseren
Jurassic Park:waarom we dertig jaar later nog steeds moeite hebben om dit te realiseren  Neanderthalers waren pioniers in de exploitatie van mariene hulpbronnen:studie
Neanderthalers waren pioniers in de exploitatie van mariene hulpbronnen:studie Wat zijn aardappelzymen?
Wat zijn aardappelzymen?  Facebook markeert gebruikers die proberen om feiten te controleren
Facebook markeert gebruikers die proberen om feiten te controleren Satellietonderzoek vindt grote verschuivingen in zoetwater wereldwijd
Satellietonderzoek vindt grote verschuivingen in zoetwater wereldwijd Een nieuwe vorm van recycling: zelfvernietigende materialen maken
Een nieuwe vorm van recycling: zelfvernietigende materialen maken Hoe kunt u de planeten in uw zonnestelsel classificeren?
Hoe kunt u de planeten in uw zonnestelsel classificeren?  Elektromagnetische golven met de hoogste energie hebben de?
Elektromagnetische golven met de hoogste energie hebben de?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

