
Wetenschap
Wat gebeurt er met de kinetische energie van deeltjes een stof als verandert van vloeibaar gas?
* Breek intermoleculaire krachten: In een vloeistof zijn deeltjes dicht bij elkaar en worden ze vastgehouden door relatief sterke intermoleculaire krachten (zoals waterstofbindingen, dipool-dipoolinteracties of dispersiekrachten in Londen). Om over te stappen naar een gas, moeten deze krachten worden overwonnen.
* Verhoogde moleculaire beweging: Naarmate de deeltjes energie krijgen, bewegen ze sneller en verder uit elkaar en overwinnen ze de intermoleculaire attracties. Deze verhoogde beweging kenmerkt een gas, waarbij deeltjes vrij zijn om in alle richtingen te bewegen.
* Energie -input: De energie die nodig is om de intermoleculaire krachten te breken en de kinetische energie van de deeltjes te vergroten, komt uit de omgeving. Dit kan in de vorm van warmte -energie zijn (zoals wanneer u water kookt) of via andere middelen zoals verminderde druk.
Samenvattend:
* vloeistof naar gasovergang vereist een toename van de kinetische energie van de deeltjes.
* Met deze energieverhoging kunnen de deeltjes intermoleculaire krachten overwinnen en vrij bewegen, wat resulteert in de gasvormige toestand.
 Wat is het atoomnummer in O2?
Wat is het atoomnummer in O2?  Welk gas wordt gevormd wanneer zink reageert met verdunde zoutzuur?
Welk gas wordt gevormd wanneer zink reageert met verdunde zoutzuur?  Een nadere blik op de verbindingen en moleculen die betrokken zijn bij het geven van cannabis zijn unieke geur
Een nadere blik op de verbindingen en moleculen die betrokken zijn bij het geven van cannabis zijn unieke geur  Waarom moet alkaliën zeepachtig aanraken?
Waarom moet alkaliën zeepachtig aanraken?  Hoe wordt de hoeveelheid stof in een gegeven eenheidsvolume genoemd?
Hoe wordt de hoeveelheid stof in een gegeven eenheidsvolume genoemd?
 Wetenschappers hebben bewijs gevonden voor een nattere wereld, vastgelegd in de Australische koraalkolonie
Wetenschappers hebben bewijs gevonden voor een nattere wereld, vastgelegd in de Australische koraalkolonie  Wat is een organische stof die de bodem vruchtbaarder maakt?
Wat is een organische stof die de bodem vruchtbaarder maakt?  Lood vrijgekomen bij brand Notre Dame in Parijse honing
Lood vrijgekomen bij brand Notre Dame in Parijse honing Finlands modderige strijd om supervervuilende veenenergie
Finlands modderige strijd om supervervuilende veenenergie Welke natuurlijke actie vlakt het omringende land plat en verrijkt de grond?
Welke natuurlijke actie vlakt het omringende land plat en verrijkt de grond?
Hoofdlijnen
- Het verlichten van sojabladeren kan de voedselvoorziening stimuleren
- Het grootste aantal organismen dat in de fotische zone leeft, is een marien bioom?
- Hoe cellulaire structuren betrokken zijn bij het synthetiseren en verpakken van eiwitten?
- Is mitochondria de plaats van anaërobe ademhaling?
- Waar zijn cel -enzymen van gemaakt?
- Een universeel raamwerk voor ruimtelijke biologie
- Studie:Luchtwegheuvels dagen ons begrip van de longbiologie uit
- Wie was de eerste wetenschapper en wat hij uitvond?
- Geef de haaien niet de schuld:uit onderzoek blijkt waarom er steeds meer gehaakte tarpoenen worden gegeten
- Video:Hortensia's en de wetenschap van doe-overs

- Willekeurige wandeling van warmtedragers in amorfe polymeren
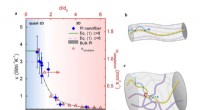
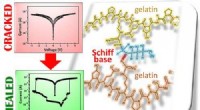
- Zelfherstellende folie op gelatinebasis kan een slimme zet zijn voor elektronica
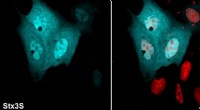
- Klasse van eiwitten die betrokken zijn bij essentiële celfuncties heeft een onverwachte rol, wetenschappers ontdekken
- Een aantal nieuwe stappen leren in de energieconversiedans

 Wat is een commerciële energie -eenheid?
Wat is een commerciële energie -eenheid?  Een kanon van massa 100 kg lanceert een kanonskogel 10 bij Velocity Ms.at hoe laat de terugslag?
Een kanon van massa 100 kg lanceert een kanonskogel 10 bij Velocity Ms.at hoe laat de terugslag?  In welke gebieden zal de bodemvorming het grootst zijn?
In welke gebieden zal de bodemvorming het grootst zijn?  Hoe zijn sterren hetzelfde?
Hoe zijn sterren hetzelfde?  Is donkere materie wazig?
Is donkere materie wazig? Zijwaartse Amerikaanse lander stuurt eerste beelden terug van de maan
Zijwaartse Amerikaanse lander stuurt eerste beelden terug van de maan  Ontrafelen hoe kalium, gebonden aan bodemmineralen, biologisch beschikbaar wordt gemaakt voor opname door planten
Ontrafelen hoe kalium, gebonden aan bodemmineralen, biologisch beschikbaar wordt gemaakt voor opname door planten  Wat is het buigen van golven als gevolg van een verandering in snelheid?
Wat is het buigen van golven als gevolg van een verandering in snelheid?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

