
Wetenschap
Nieuwe core-shell-katalysator voor ethanolbrandstofcellen
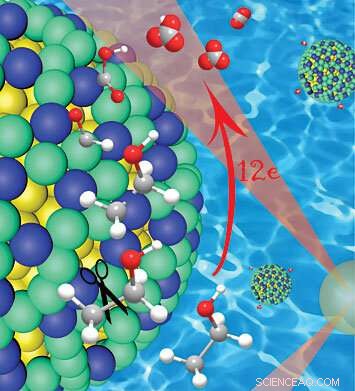
Een close-up van de platina/iridium (groen/blauw) schil over een gouden nanodeeltjeskern (geel), laat zien hoe deze katalysator de koolstof-koolstof (grijze) bindingen in ethanol splitst, terwijl aanvankelijk waterstofatomen vast blijven zitten. De waterstof beschermt de koolstof in de vroege stadia van de reactie, voorkomen van de vorming van katalysator-vergiftiging koolmonoxide, die volledige oxidatie en het vrijkomen van 12 elektronen mogelijk maakt. Krediet:Brookhaven National Laboratory
Wetenschappers van het Brookhaven National Laboratory van het Amerikaanse Department of Energy (DOE) en de University of Arkansas hebben een zeer efficiënte katalysator ontwikkeld voor het extraheren van elektrische energie uit ethanol, een gemakkelijk op te slaan vloeibare brandstof die kan worden gegenereerd uit hernieuwbare bronnen. De katalysator, beschreven in de Tijdschrift van de American Chemical Society , stuurt de elektro-oxidatie van ethanol langs een ideale chemische weg die het volledige potentieel van opgeslagen energie van de vloeibare brandstof vrijmaakt.
"Deze katalysator is een gamechanger die het gebruik van ethanolbrandstofcellen mogelijk zal maken als een veelbelovende bron van 'off-the-grid' elektrische stroom met hoge energiedichtheid, " zei Jia Wang, de Brookhaven Lab-chemicus die het werk leidde. Een bijzonder veelbelovende toepassing:drones op vloeibare brandstofcellen.
"Ethanolbrandstofcellen zijn lichtgewicht in vergelijking met batterijen. Ze zouden voldoende vermogen leveren voor het besturen van drones met vloeibare brandstof die gemakkelijk tussen vluchten kan worden bijgevuld, zelfs op afgelegen locaties, ’ merkte Wang op.
Veel van de potentiële kracht van ethanol zit opgesloten in de koolstof-koolstofbindingen die de ruggengraat van het molecuul vormen. De door Wang's groep ontwikkelde katalysator onthult dat het verbreken van die banden op het juiste moment de sleutel is tot het ontsluiten van die opgeslagen energie.
"Elektro-oxidatie van ethanol kan 12 elektronen per molecuul produceren, " zei Wang. "Maar de reactie kan vorderen door veel verschillende wegen te volgen."
De meeste van deze routes resulteren in onvolledige oxidatie:de katalysatoren laten koolstof-koolstofbindingen intact, minder elektronen vrijgeven. Ze strippen ook al vroeg in het proces waterstofatomen af, het blootstellen van koolstofatomen aan de vorming van koolmonoxide, die het vermogen van de katalysatoren om in de loop van de tijd te functioneren "vergiftigt".

Brookhaven Lab-leden van het onderzoeksteam dat een nieuwe core-shell-katalysator heeft ontwikkeld en gekarakteriseerd voor volledige elektro-oxidatie van ethanol (l naar r):Radoslav Adzic, Zhixiu Liang, Jia Wang, Eli Stavitski, en Liang Song. Krediet:Brookhaven National Laboratory
"De volledige oxidatie van ethanol met 12 elektronen vereist het verbreken van de koolstof-koolstofbinding aan het begin van het proces, terwijl waterstofatomen nog steeds vastzitten, omdat de waterstof de koolstof beschermt en de vorming van koolmonoxide voorkomt, " zei Wang. Toen, meerdere stappen van dehydrogenering en oxidatie zijn nodig om het proces te voltooien.
De nieuwe katalysator, die reactieve elementen combineert in een unieke kern-schaalstructuur die wetenschappers van Brookhaven hebben onderzocht voor een reeks katalytische reacties, versnelt al deze stappen.
Om de katalysator te maken, Jingyi Chen van de Universiteit van Arkansas, die een deel van dit project gastwetenschapper was bij Brookhaven, ontwikkelde een synthesemethode om platina en iridium samen op gouden nanodeeltjes af te zetten. Het platina en iridium vormen "monoatomaire eilanden" over het oppervlak van de gouden nanodeeltjes. die regeling, Chen merkte op, is de sleutel die verantwoordelijk is voor de uitstekende prestaties van de katalysator.
"De gouden nanodeeltjeskernen induceren trekspanning in de platina-iridium mono-atomaire eilanden, wat het vermogen van die elementen om de koolstof-koolstofbindingen te splitsen vergroot, en dan zijn waterstofatomen weghalen, " ze zei.
Zhixiu Liang, een afgestudeerde student van Stony Brook University en de eerste auteur van het artikel, voerde studies uit in het laboratorium van Wang om te begrijpen hoe de katalysator zijn recordhoge energieconversie-efficiëntie bereikt. Hij gebruikte "in situ infrarood reflectie-absorptie spectroscopie" om de reactie tussenproducten en producten te identificeren, het vergelijken van die geproduceerd door de nieuwe katalysator met reacties met behulp van een goudkern/platina-omhulselkatalysator en ook een platina-iridiumlegeringskatalysator.

Een schema dat laat zien hoe de "monoatomaire eilanden" van platina (groen) en iridium (blauw) op het gouden nanodeeltjesoppervlak (geel) een volledige 12-elektronenoxidatie van ethanol mogelijk maken zonder koolmonoxidevergiftiging. De grafiek illustreert de dramatisch hogere piekstroom geproduceerd door de nieuwe katalysator (Au@PtIr) in vergelijking met drie andere katalysatoren:gouden kern/iridiumomhulsel (Au@Ir); iridium/platinalegering (IrPt); en gouden kern/platina omhulsel (Au@Pt). Krediet:Brookhaven National Laboratory
"Door de spectra te meten die worden geproduceerd wanneer het infraroodlicht wordt geabsorbeerd in verschillende stappen in de reactie, deze methode stelt ons in staat om te volgen, bij elke stap, welke soorten zijn gevormd en hoeveel van elk product, Liang zei. "De spectra onthulden dat de nieuwe katalysator ethanol naar de 12-elektronen volledige oxidatieroute stuurt, het volledige potentieel van opgeslagen energie van de brandstof vrijmaken."
De volgende stap, Wang merkte op, is om apparaten te ontwikkelen die de nieuwe katalysator bevatten.
De mechanistische details die door deze studie worden onthuld, kunnen ook helpen bij het rationele ontwerp van toekomstige multicomponent-katalysatoren voor andere toepassingen.
 Verboden industrieel oplosmiddel werpt nieuw licht op methaanmysterie (update)
Verboden industrieel oplosmiddel werpt nieuw licht op methaanmysterie (update) Onderzoekers van het Braziliaanse ruimteinstituut ontdekken waarom bliksem vertakt en flikkert
Onderzoekers van het Braziliaanse ruimteinstituut ontdekken waarom bliksem vertakt en flikkert Cross Seas zijn zeldzaam maar gevaarlijk
Cross Seas zijn zeldzaam maar gevaarlijk  Arabisch Schiereiland een val voor zomerstof
Arabisch Schiereiland een val voor zomerstof Enorme kraters gevormd door methaanuitbarstingen van de Arctische zeebodem
Enorme kraters gevormd door methaanuitbarstingen van de Arctische zeebodem
Hoofdlijnen
- Een bacterieel stroomdiagram maken
- Wat zijn de stappen van de stikstofcyclus?
- Hoe kunnen kinderen van dezelfde ouders er zo verschillend uitzien?
- Stadia van een typische celcyclus
- Psychologische theorie over de vijf menselijke zintuigen
- Wat zijn de drie belangrijkste verschillen tussen een plantencel en een dierlijke cel?
- Uit welke elementen bestaat glucose?
- Projectideeën om het menselijk spijsverteringssysteem op de middelbare school voor studenten te laten zien
- De centrale hoek vinden
- Chemici bedenken nieuwe Lewis-zuurtest met behulp van fluorescentie

- Wetenschappers gebruiken katalysatoren om kankercellen van binnenuit te vernietigen
- Fibrillen omzetten in kristallen

- Onderzoekers bereiken doorbraak in 3D-geprint roestvrij staal van mariene kwaliteit

- Inzichten op atoomniveau helpen de degradatie in brandstofcellen te verminderen en hun levensduur te verlengen

 Chemie maakt de weg vrij voor verbeterde elektronische materialen
Chemie maakt de weg vrij voor verbeterde elektronische materialen Twee worden één met de 3D NanoChemiscope
Twee worden één met de 3D NanoChemiscope Sterke aardbeving treft het Griekse Kreta, geen gewonden gemeld
Sterke aardbeving treft het Griekse Kreta, geen gewonden gemeld Nieuw algoritme voor het simuleren van de structuur van kwantumsystemen op een kwantumfotonische chip
Nieuw algoritme voor het simuleren van de structuur van kwantumsystemen op een kwantumfotonische chip Draadloze communicatie breekt door de water-luchtbarrière
Draadloze communicatie breekt door de water-luchtbarrière Classificatie van petrochemicaliën
Classificatie van petrochemicaliën Een beschrijving van het doel van mitose
Een beschrijving van het doel van mitose Misdaadpatronen ontdekken met behulp van locatiegegevens
Misdaadpatronen ontdekken met behulp van locatiegegevens
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

