
Wetenschap
Waarom ionische binding energetisch gunstig tussen element van groep 1 2 6 en 7?
Inzicht in de basis
* ionische bindingen: Deze bindingen vormen zich wanneer een metaal (meestal van groepen 1 en 2) elektronen verliest om een positief geladen ion (kation) te worden en een niet -metaal (meestal uit groepen 6 en 7) die elektronen krijgt als een negatief geladen ion (anion). De elektrostatische aantrekkingskracht tussen deze tegengesteld geladen ionen houdt de binding bij elkaar.
* Elektrostatische aantrekkingskracht: De fundamentele drijvende kracht achter de vorming van ionische bindingen is de sterke aantrekkingskracht tussen tegengestelde ladingen. Deze aantrekkingskracht geeft energie vrij, waardoor het proces gunstig wordt.
Waarom groepen 1, 2, 6 en 7?
* Groep 1 en 2 (alkali en alkalische aardmetalen): Deze metalen hebben slechts één of twee valentie -elektronen (elektronen in de buitenste schaal). Ze verliezen deze elektronen gemakkelijk om een stabiele, edelgasconfiguratie te bereiken. Daarom vormen ze kationen.
* Groep 6 en 7 (chalcogenen en halogenen): Deze niet -metalen hebben zes of zeven valentie -elektronen. Ze krijgen elektronen om hun octet te voltooien en een edelgasconfiguratie te bereiken, die anionen vormen.
Energievoorzienbaarheid
1. Lagere energietoestand: Door ionen te vormen, bereiken de elementen een stabielere elektronenconfiguratie, die is geassocieerd met lagere energie. Deze afname van energie is een drijvende kracht voor de bindingsvorming.
2. Roosterergie: De aantrekkingskracht tussen ionen in een vast kristalrooster is aanzienlijk. Deze attractie geeft energie vrij, bekend als roosterergie. Hoe groter de lading van de ionen en hoe kleiner hun grootte, hoe sterker de roosterergie.
Voorbeeld:
* Natrium (NA) uit groep 1 heeft één valentie -elektron. Het verliest gemakkelijk dit elektron om een Na+ -kation te worden.
* Chloor (CL) uit groep 7 heeft zeven valentie -elektronen. Het krijgt één elektron om een cl-anion te worden.
* De sterke elektrostatische aantrekkingskracht tussen Na+ en Clionen vormt een ionische binding, waardoor NaCl (tafelzout) ontstaat. Het resulterende kristalrooster heeft aanzienlijke roosterergie.
Sleutelpunten:
* Ionische bindingen worden aangedreven door de wens om stabiele elektronenconfiguraties te bereiken.
* Elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen geeft energie vrij, waardoor de binding gunstig wordt.
* Hoe groter de lading van de ionen en hoe kleiner hun grootte, hoe sterker de ionische binding.
Samenvattend creëert de combinatie van elementen uit groepen 1, 2, 6 en 7 ionische bindingen vanwege de gunstige energieveranderingen die optreden wanneer ze ionen vormen en stabiele elektronische configuraties bereiken. De resulterende ionische verbindingen worden bij elkaar gehouden door sterke elektrostatische krachten, waardoor ze zeer stabiel zijn.
 Kleine boerderijen produceren meer voedsel dan statistieken laten zien
Kleine boerderijen produceren meer voedsel dan statistieken laten zien Bladdaken:Puerto Rico wikkelt 2 jaar na orkaan Maria
Bladdaken:Puerto Rico wikkelt 2 jaar na orkaan Maria NASA's Terra-satelliet ziet een zeer koppige post-tropische cycloon Jose
NASA's Terra-satelliet ziet een zeer koppige post-tropische cycloon Jose Biotische factoren in woestijnen
Biotische factoren in woestijnen  Tyfoons en mariene eutrofiëring zijn waarschijnlijk de ontbrekende bron van organische stikstof in ecosystemen
Tyfoons en mariene eutrofiëring zijn waarschijnlijk de ontbrekende bron van organische stikstof in ecosystemen
Hoofdlijnen
- Hoe reproduceren bacteriecellen zich?
- Wat is het weefsel dat bestaat uit celvezels en matrix?
- Waar in de cel bevinden zich enzymen?
- Waar bestaat een cel uit?
- Planten en hun wetenschappelijke gemeenschappelijke namen?
- Een buis gevormd door de innerlijke uitbreiding van het celmembraan wordt A genoemd?
- Biologen onderzoeken waarom de zoete smaak van suikerhoudend voedsel afneemt als het gekoeld is
- Functie van heterocyten gevonden in Cynaobacteria?
- De rol van de longen
- Bruine koolstof van aromatische verontreinigende stoffen wordt uitgestoten tijdens verbranding en bosbranden
- Een geweldige nieuwe manier om 3D-geprinte objecten te schilderen

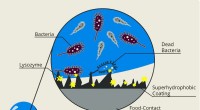
- Nieuwe coating met dubbele werking voorkomt dat bacteriën kruisbesmetting van verse producten mogelijk maken
- Wetenschappers optimaliseren de productiviteit van het productieproces van pultrusie

- Nieuw proces van bacteriën en algen kan helpen om het Britse leger koolstofarm te maken

 Wat zijn vulkanische stollingsformaties?
Wat zijn vulkanische stollingsformaties?  Wanneer zijn dinosauriërs uitgestorven? De theorieën over hoe het gebeurde en wat overleefde
Wanneer zijn dinosauriërs uitgestorven? De theorieën over hoe het gebeurde en wat overleefde  Donutstralen helpen natuurkundigen ongelooflijk kleine objecten te zien
Donutstralen helpen natuurkundigen ongelooflijk kleine objecten te zien  Waarom wetenschappers het klimaat hebben gemodelleerd tot het jaar 2300
Waarom wetenschappers het klimaat hebben gemodelleerd tot het jaar 2300 Zijn de genen in dochtercellen geproduceerd door mitosen hetzelfde als of verschillend van de originele cel?
Zijn de genen in dochtercellen geproduceerd door mitosen hetzelfde als of verschillend van de originele cel?  Welk effect heeft de zwaartekracht op hemelse lichamen?
Welk effect heeft de zwaartekracht op hemelse lichamen?  Chinese astronauten trainen voor bemande vluchten van ruimtestation
Chinese astronauten trainen voor bemande vluchten van ruimtestation Hoe gebruiken astronomen het spectrum van een object om informatie te verkrijgen over wat er van is gemaakt?
Hoe gebruiken astronomen het spectrum van een object om informatie te verkrijgen over wat er van is gemaakt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

