
Wetenschap
Hoe de bewegingen van gasdeeltjes gerelateerd zijn aan druk door gas?
1. Kinetische moleculaire theorie:
* De kinetische moleculaire theorie van gassen beschrijft het gedrag van gasdeeltjes op basis van hun constante, willekeurige beweging.
* Key postulaten zijn onder meer:
* Gasdeeltjes zijn in constante, willekeurige beweging.
* De deeltjes zijn veel kleiner dan de afstanden daartussen.
* Botsingen tussen deeltjes zijn perfect elastisch (geen energieverlies).
* Er zijn geen aantrekkelijke of afstotende krachten tussen deeltjes.
2. Botsingen en druk:
* Gasdruk komt voort uit de botsingen van gasdeeltjes met de wanden van hun container.
* Elke botsing oefent een kleine kracht op de muur uit.
* De frequenter de botsingen, de hogere de druk.
* De krachtiger de botsingen, de hogere de druk.
3. Factoren die deeltjesbeweging beïnvloeden:
* Temperatuur: Hogere temperatuur betekent hogere deeltjessnelheden, wat leidt tot frequentere en krachtige botsingen, dus een hogere druk.
* Volume: Kleinere volume betekent dat deeltjes vaker met de wanden botsen, wat resulteert in een hogere druk.
* Aantal deeltjes: Meer deeltjes betekenen meer botsingen, wat leidt tot hogere druk.
4. Wiskundige relatie (ideale gaswet):
De relatie tussen druk, volume, temperatuur en het aantal deeltjes wordt ingekapseld door de ideale gaswet:
* pv =nrt
* P =druk
* V =volume
* n =aantal mol gas
* R =ideale gasconstante
* T =temperatuur (in kelvin)
5. Samenvatting:
* Gasdruk is een direct gevolg van de beweging van gasdeeltjes.
* De frequentie en kracht van botsingen tussen gasdeeltjes en de containerwanden bepalen de druk.
* Temperatuur, volume en het aantal deeltjes beïnvloeden allemaal deeltjesbeweging en dus gasdruk.
In wezen, hoe sneller en talrijker de gasdeeltjes zijn, en hoe kleiner de ruimte die ze innemen, hoe meer botsingen ze zullen hebben met de containerwanden, wat resulteert in een hogere gasdruk.
 Welk carbonaatmineraal reageert gemakkelijk met koud verdund zoutzuur en produceert zichtbare bellen kooldioxidegas?
Welk carbonaatmineraal reageert gemakkelijk met koud verdund zoutzuur en produceert zichtbare bellen kooldioxidegas?  Wat zijn 2 voorbeelden van mechanische en chemische verwering?
Wat zijn 2 voorbeelden van mechanische en chemische verwering?  Wat is een eigenschappen van vloeistoffen?
Wat is een eigenschappen van vloeistoffen?  In welke temperaturen groeien Borax -kristallen het beste?
In welke temperaturen groeien Borax -kristallen het beste?  Team lost tien jaar oud mysterie op in chemische transformaties
Team lost tien jaar oud mysterie op in chemische transformaties
 Antarctisch zee-ijs 2016, recordlaagte door perfecte storm van tropische, polaire omstandigheden
Antarctisch zee-ijs 2016, recordlaagte door perfecte storm van tropische, polaire omstandigheden NASA test waarnemingsvermogen op de koraalriffen van Hawaï
NASA test waarnemingsvermogen op de koraalriffen van Hawaï Hoe zullen de grootste tropische bomen reageren op klimaatverandering?
Hoe zullen de grootste tropische bomen reageren op klimaatverandering?  Brandweerlieden houden vuur Canarische Eilanden onder controle:ambtenaren
Brandweerlieden houden vuur Canarische Eilanden onder controle:ambtenaren De kenmerken van een vochtig, tropisch klimaat
De kenmerken van een vochtig, tropisch klimaat
Hoofdlijnen
- Welk orgaan is nodig in een aseksuele reproductie?
- Dieren wiens basislichaamsplan kan worden omschreven als een buis erin zijn de?
- Hoe kun je zien of het een dierlijke cel of een plantencel is?
- Wat zijn de twee verschillende stadia van meiose?
- Gezonde biggen? Niet met sulfonamiden
- Welke weefsels komen voor in planten en dieren?
- Hoe worden levende organismen momenteel gecategoriseerd?
- De meeste gespecialiseerde cellen blijven in welke fase van de levenscyclus?
- Zijn pesticiden die worden gebruikt in stedelijke en voorstedelijke gebieden schadelijk voor honingbijen?
- Chemici nemen de plek waar water en lucht samenkomen onder de loep
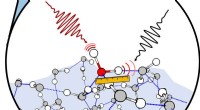
- Gewone microben werken samen om polymeercomposieten af te breken

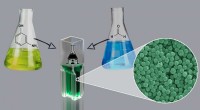
- Chemici ontwikkelen methode om katalysator-, oppervlakteactieve en sjabloonvrije polymere nanodeeltjes
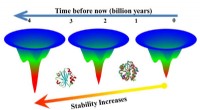
- Eiwitten die tegen de hitte kunnen
- Emissievrije dieselverbranding met een niet-evenwichtsplasma-ondersteund MnO2-filter

 IJslenzen kunnen veel Arctische aardverschuivingen veroorzaken
IJslenzen kunnen veel Arctische aardverschuivingen veroorzaken Hoe beïnvloeden zowel genen als omgevingen eigenschappen?
Hoe beïnvloeden zowel genen als omgevingen eigenschappen?  Nucleatie van vloeistoffen gevisualiseerd
Nucleatie van vloeistoffen gevisualiseerd Waar komt de bron van kernenergie vandaan?
Waar komt de bron van kernenergie vandaan?  Zal de Amerikaanse regering Boeing nationaliseren?
Zal de Amerikaanse regering Boeing nationaliseren? Facebook checken op het werk? Je baas vindt het waarschijnlijk niet leuk
Facebook checken op het werk? Je baas vindt het waarschijnlijk niet leuk  Leg uit hoe water beweegt als golfenergie erdoorheen reist?
Leg uit hoe water beweegt als golfenergie erdoorheen reist?  Wordt in de huidvetlaag ook wel genoemd?
Wordt in de huidvetlaag ook wel genoemd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

