
Wetenschap
Latente warmte in termen van moleculair gedrag?
latente warmte:een moleculair perspectief
Latente warmte is de geabsorbeerde of afgifte energie tijdens een faseverandering, waarbij de temperatuur constant blijft. Deze energie verandert niet de temperatuur van de stof, maar verandert in plaats daarvan de opstelling van zijn moleculen, waardoor de fysieke toestand (vaste, vloeistof of gas) verandert.
Hier is hoe het op moleculair niveau werkt:
1. Het breken en vormen van bindingen:
* smelten en verdamping: Tijdens het smelten en verdamping wordt energie geabsorbeerd om de aantrekkelijke krachten te overwinnen die de moleculen in een vaste of vloeibare toestand bij elkaar houden. Deze krachten zijn sterker in vaste stoffen dan in vloeistoffen, waarin wordt uitgelegd waarom de latente fusiewarmte (smelten) typisch lager is dan de latente verdampingswarmte.
* bevriezen en condensatie: Tijdens het bevriezen en condensatie wordt energie vrijgegeven terwijl de moleculen zich in een meer geordende toestand regelen, waardoor sterkere intermoleculaire bindingen worden gevormd.
2. Moleculaire beweging:
* vaste stoffen: Moleculen in vaste stoffen hebben een vaste positie en trillen rond deze posities. Ze hebben een beperkte bewegingsvrijheid en worden bij elkaar gehouden door sterke intermoleculaire krachten.
* vloeistoffen: Moleculen in vloeistoffen hebben meer bewegingsvrijheid in vergelijking met vaste stoffen. Ze kunnen zich binnen de vloeistof bewegen en worden bij elkaar gehouden door zwakkere intermoleculaire krachten.
* gassen: Moleculen in gassen hebben de meeste bewegingsvrijheid. Ze zijn ver uit elkaar en bewegen snel en willekeurig. Ze hebben te verwaarlozen intermoleculaire krachten.
3. Energieveranderingen:
* Latent warmte toevoegen: Wanneer latente warmte wordt toegevoegd, wordt de energie -input gebruikt om intermoleculaire bindingen te verbreken en de gemiddelde kinetische energie van de moleculen te vergroten, wat leidt tot een verandering in de fase van de stof. De temperatuur blijft constant tijdens dit proces omdat de energie gaat om de moleculen te herschikken, waardoor hun kinetische energie niet wordt vergroot.
* Latent warmte vrijgeven: Wanneer latente warmte wordt vrijgegeven, wordt energie afgegeven omdat moleculen sterkere bindingen vormen en vertragen. Deze verandering in de toestand van de stof heeft geen direct invloed op de gemiddelde kinetische energie en daarom blijft de temperatuur constant.
Voorbeeld:water
* smeltend ijs: Wanneer ijs smelt, breekt de energie -input de waterstofbindingen die de watermoleculen in een stijve roosterstructuur houden. Hierdoor kunnen de moleculen vrijer bewegen en overgaan in een vloeibare toestand.
* kokend water: Wanneer water kookt, verbreekt de energie -input de waterstofbindingen die de watermoleculen dicht bij elkaar houden in de vloeibare toestand. De moleculen ontsnappen in de gasfase en worden waterdamp.
Samenvattend:
Latent warmte is de energie geassocieerd met het breken of vormen van intermoleculaire bindingen, wat een sleutelfactor is die de fase van materie bepaalt. Het is direct gerelateerd aan het moleculaire gedrag en de energie die nodig is om de opstelling van moleculen in een stof te veranderen.
 Zes regels voor de wederopbouw van infrastructuur in een tijdperk van ongekende weersomstandigheden
Zes regels voor de wederopbouw van infrastructuur in een tijdperk van ongekende weersomstandigheden Vraag en antwoord:Een wetenschapper legt het waarom van de natuurbrandcrisis in Californië uit
Vraag en antwoord:Een wetenschapper legt het waarom van de natuurbrandcrisis in Californië uit Onderzoek naar klimaatadaptatie in realtime toegepast
Onderzoek naar klimaatadaptatie in realtime toegepast  Olieopruiming in Zuid-Nigeria nog ver van doel
Olieopruiming in Zuid-Nigeria nog ver van doel Verschillende soorten bladeren
Verschillende soorten bladeren
Hoofdlijnen
- Live-beelden in 3D laten zien hoe planten nieuwe zijwortels krijgen
- Waarom is bioloog meestal gespecialiseerd in één subtak van de biologie?
- Wat is een biocapaciteit?
- Hoe zorgt de natuurlijke selectie ervoor dat de evolutie optreedt?
- Hoeveel zintuigen heeft de mens?
- Wat gebeurt er met de cel als de baby groter wordt?
- Waarom is een lichaam minder snel afgewezen en allograft als het uit het relatieve komt?
- Wat is celluloid?
- Leven gelukkige mensen langer?
- Nieuwe coating kan grote gevolgen hebben voor lithiumbatterijen
- Nieuwe plutonium-ontdekking verlicht de weg om nucleair afval op te ruimen

- Hier is een draai aan een eeuwenoude klassieker:Lactosevrije chocolademelk

- Een op de natuur geïnspireerde coating om te voorkomen dat medicijnen te vroeg afbreken

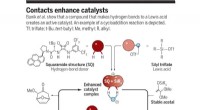
- Katalysatoren zoals een pincet gebruiken om één enantiomeer uit een gespiegeld paar te selecteren
 Welke kracht bestand is tegen beweging wanneer het oppervlak van het ene object tegen het andere beweegt?
Welke kracht bestand is tegen beweging wanneer het oppervlak van het ene object tegen het andere beweegt?  Wanneer warmte wordt geleverd aan een vaste stof, wat doet de energie dan vasteeltjes vast?
Wanneer warmte wordt geleverd aan een vaste stof, wat doet de energie dan vasteeltjes vast?  Waarom worden ammoniumzouten gemaakt?
Waarom worden ammoniumzouten gemaakt?  Hoe heeft Newton de tweede bewegingswet ontdekt?
Hoe heeft Newton de tweede bewegingswet ontdekt?  Drie exokometen ontdekt rond de ster Beta Pictoris
Drie exokometen ontdekt rond de ster Beta Pictoris Onderzoekers creëren ingrediënten om voedsel te produceren door middel van 3D-printen
Onderzoekers creëren ingrediënten om voedsel te produceren door middel van 3D-printen Reis naar het centrum van de cel:nanostaafjes en wormen kronkelen het best
Reis naar het centrum van de cel:nanostaafjes en wormen kronkelen het best Hoe bereikt de buis van de pollenkorrels eierstok?
Hoe bereikt de buis van de pollenkorrels eierstok?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

