
Wetenschap
Wanneer vaste en vloeibare fasen in evenwicht zijn welke fase of de grotere hoeveelheid energie bevat?
* intermoleculaire krachten: Moleculen in een vloeistof hebben zwakkere intermoleculaire krachten (zoals waterstofbruggen, dipool-dipoolinteracties of Londense dispersiekrachten) in vergelijking met moleculen in een vaste stof. Dit betekent dat ze meer vrijheid hebben om te bewegen.
* Kinetische energie: De zwakkere krachten in vloeistoffen zorgen ervoor dat moleculen hogere kinetische energie hebben (beweging van beweging). Dit betekent dat ze trillen, roteren en gemakkelijker vertalen dan moleculen in een vaste stof.
* Fusiewarmte: Om een vaste stof in een vloeistof te veranderen, moet u energie (warmte) toevoegen om die sterkere intermoleculaire krachten te breken die de vaste stof bij elkaar houden. Deze energie wordt geabsorbeerd door de stof en wordt onderdeel van zijn interne energie.
Denk er op deze manier aan:
Stel je voor dat een groep mensen stevig samen in een koude kamer (vaste toestand) kruipt. Ze houden elkaar allemaal vast en bewegen nauwelijks. Stel je nu voor dat de kamer opwarmt (het toevoegen van warmte -energie). De mensen beginnen meer te bewegen, breken los van sommige van hun strakke golds en ze zijn nu meer verspreid (vloeibare toestand). Ze hebben nu meer energie, waardoor een grotere beweging mogelijk is.
evenwicht:
Wanneer een vaste stof en vloeistof in evenwicht zijn, betekent dit dat de snelheid van smelten (vaste stof tot vloeistof) gelijk is aan de snelheid van bevriezing (vloeistof tot vast). Op dit punt is het energie -gehalte van de vloeibare en vaste fasen hetzelfde, maar de vloeibare moleculen hebben een grotere * verdeling * van energie vanwege hun zwakkere krachten en verhoogde mobiliteit.
 Hoe heeft het werk van chemicaliën de omgeving beïnvloed?
Hoe heeft het werk van chemicaliën de omgeving beïnvloed?  Wat converteert stikstof in de cyclus?
Wat converteert stikstof in de cyclus?  WAT ZIJN DE STRUCTUREN VAN DE BELANGRIJKSTE EN KLEINERE PRODUCTEN DIE WORDEN VERKREGEN WANNEER 1-METHYLCYCLOHEXANOL WORDT GEDEHYDRATEERD SING CONC. ZWAVELZUUR?
WAT ZIJN DE STRUCTUREN VAN DE BELANGRIJKSTE EN KLEINERE PRODUCTEN DIE WORDEN VERKREGEN WANNEER 1-METHYLCYCLOHEXANOL WORDT GEDEHYDRATEERD SING CONC. ZWAVELZUUR?  Wat gebeurt er met een atoom als het meer elektronen dan protonen heeft?
Wat gebeurt er met een atoom als het meer elektronen dan protonen heeft?  Wat zorgt ervoor dat chemische binding tijdens een reactie breken?
Wat zorgt ervoor dat chemische binding tijdens een reactie breken?
 Geleidbaarheidssleutel om water in de aarde in kaart te brengen
Geleidbaarheidssleutel om water in de aarde in kaart te brengen Ontbossing bevordert een toename van de diversiteit van antibioticaresistente bodembacteriën
Ontbossing bevordert een toename van de diversiteit van antibioticaresistente bodembacteriën Wat is een regenwoud in zin?
Wat is een regenwoud in zin?  Wat is een overstroming en waarom is de watervloed zo gevaarlijk?
Wat is een overstroming en waarom is de watervloed zo gevaarlijk?  Wanneer natuurrampen plaatselijk toeslaan, stedelijke netwerken verspreiden de schade wereldwijd
Wanneer natuurrampen plaatselijk toeslaan, stedelijke netwerken verspreiden de schade wereldwijd
Hoofdlijnen
- De vergeten wetenschapper die de weg vrijmaakte voor de ontdekking van de DNA-structuur
- Nieuwe soorten mariene spin verschijnen bij eb om wetenschappers aan Bob Marley te herinneren
- Welke biologiewoorden beginnen met de letter y?
- Hoe classificeren we micro -organismen?
- Er komen aanwijzingen naar voren:hoe ongevaarlijke bacteriën zich ontwikkelen tot dodelijke vleesetende varianten
- Waarom kunnen we de voetstappen van anderen horen,
- Hoe neemt een forel zuurstof in?
- Wat is het antoniem van Biome?
- Wie heeft mannen nodig? Vrouwelijke haaien maken alleen baby's in Italië
- Astronauten voeren metallurgische experimenten uit aan boord van ISS

- Covalente koolstof-koolstofbindingen veel flexibeler dan verondersteld
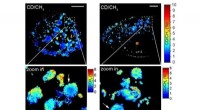
- Onderzoekers vergroten verborgen biologische structuren door SRS en expansiemicroscopie te combineren
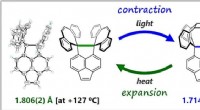
- Nieuw organisch plastic materiaal zorgt ervoor dat elektronica bij extreme temperaturen kan functioneren zonder in te boeten aan prestaties

- De grootste maan van Saturnus kan de sleutel zijn tot schonere motoren

 Welk type metabolisme doet Archaea?
Welk type metabolisme doet Archaea?  Hoe de interne klok van onze cellen wordt beïnvloed door mechanische krachten
Hoe de interne klok van onze cellen wordt beïnvloed door mechanische krachten  Kan wapengeweld worden herleid tot sociaaleconomische grondoorzaken?
Kan wapengeweld worden herleid tot sociaaleconomische grondoorzaken? De sterren die je 's nachts ziet, zijn?
De sterren die je 's nachts ziet, zijn?  Onderzoekers onthullen patronen van seksueel misbruik in religieuze omgevingen
Onderzoekers onthullen patronen van seksueel misbruik in religieuze omgevingen PluggedIn:heeft uw online imago een make-over nodig?
PluggedIn:heeft uw online imago een make-over nodig?  Er zijn drie elementen die deel uitmaken van een transportsysteem dat dit zijn?
Er zijn drie elementen die deel uitmaken van een transportsysteem dat dit zijn?  Hoe nanorobots zullen werken
Hoe nanorobots zullen werken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

