
Wetenschap
Waarom kunnen de deeltjes van gas veranderen en vaste stoffen niet?
gassen:
* arrangement: Deeltjes zijn ver uit elkaar en willekeurig gerangschikt.
* Beweging: Deeltjes bewegen zeer snel en vrij in alle richtingen en botsen met elkaar en de containerwanden.
* Wijzigingen: Vanwege hun hoge kinetische energie kunnen gasdeeltjes zich gemakkelijk verspreiden om elke container te vullen waarin ze zich bevinden. Ze zijn ook samendrukbaar, wat betekent dat hun volume aanzienlijk kan veranderen met druk.
vaste stoffen:
* arrangement: Deeltjes zijn strak verpakt in een regelmatig, herhaaldelijk patroon (zoals een kristalrooster).
* Beweging: Deeltjes trillen in vaste posities, met beperkte beweging.
* Wijzigingen: Terwijl individuele deeltjes trillen, blijft hun algemene opstelling grotendeels vast. Dit geeft vaste stoffen een duidelijke vorm en volume. Ze zijn niet gemakkelijk gecomprimeerd.
Het belangrijkste verschil:
De sterkte van de krachten van aantrekkingskracht tussen deeltjes bepaalt hun toestand.
* In gassen zijn deze krachten erg zwak.
* In vaste stoffen zijn deze krachten erg sterk.
Dit is de reden waarom gasdeeltjes vrij kunnen bewegen, terwijl vaste deeltjes in een vaste structuur worden gehouden.
Belangrijke opmerking: Het is vermeldenswaard dat zelfs vaste stoffen een zekere mate van deeltjesbeweging hebben. Dit is de reden waarom vaste stoffen uitzetten wanneer ze worden verwarmd. Door de verhoogde energie kunnen deeltjes trillen met een grotere amplitude, wat leidt tot een lichte expansie. De algehele structuur blijft echter intact.
 NASA onderzoekt de extreme regenval in Nieuw-Zeeland terwijl de resten van de cycloonkoks wegtrekken
NASA onderzoekt de extreme regenval in Nieuw-Zeeland terwijl de resten van de cycloonkoks wegtrekken De biodiversiteit op aarde:wat weten we en waar gaan we heen?
De biodiversiteit op aarde:wat weten we en waar gaan we heen?  Wat de wereld kan leren van de verwoestende overstromingen in Pakistan
Wat de wereld kan leren van de verwoestende overstromingen in Pakistan De basismechanismen van evolutionaire verandering kunnen niet in de natuur worden waargenomen?
De basismechanismen van evolutionaire verandering kunnen niet in de natuur worden waargenomen?  GPM-satelliet vindt zware regenval in krachtige orkaanlaan
GPM-satelliet vindt zware regenval in krachtige orkaanlaan
Hoofdlijnen
- Hoe heet het wanneer Abacterium een pilus gebruikt om zijn DNA over te dragen?
- Welke gespecialiseerde weefsels hebben vasculaire planten die andere planten?
- Uit onderzoek blijkt waarom de zebra zijn strepen kreeg
- Een dodelijke schimmel die het witte-neussyndroom veroorzaakt, kan een achilleshiel hebben, studie onthult
- Belangrijke feiten over het koninkrijk Monera
- Cellulaire route zou bewijs kunnen leveren van hoe kanker en obesitas met elkaar verbonden zijn
- De twee factoren die bijdragen aan de diversiteit van soorten?
- Wat is Achoholic Fermintaition?
- Kraaien en keapapegaaien blijken het nut van objecten te leren, vergelijkbaar met de manier waarop menselijke baby's het doen
- Cementfabrieken kunnen de wereldwijde plasticvervuiling afremmen

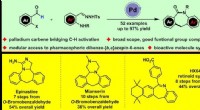
- Modulaire benadering van dibenzo-gefuseerde ε-lactams door middel van carbeen overbruggende CH-activering
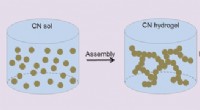
- Carbonitride-aerogels bemiddelen de fotokatalytische omzetting van water
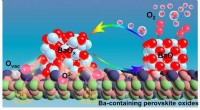
- Mechanisme van zuurstofactivering op bariumbevattende perovskietmaterialen
- Forensisch chemicus gebruikt zweet om personen op plaats delict te onderscheiden

 Waar is het type rots van waar oceanische platen van zijn gemaakt?
Waar is het type rots van waar oceanische platen van zijn gemaakt?  Wetenschappers creëren een voertuig op nanoschaal om kanker te bestrijden zonder gezonde cellen te beschadigen
Wetenschappers creëren een voertuig op nanoschaal om kanker te bestrijden zonder gezonde cellen te beschadigen Wat zijn heldere strepen rond een maankrater?
Wat zijn heldere strepen rond een maankrater?  Hoe het luisteren naar Noord-Atlantische walvissen mensen kan helpen hen te beschermen
Hoe het luisteren naar Noord-Atlantische walvissen mensen kan helpen hen te beschermen  Wat is een organisme dat zijn eigen voedsel voortbrengt uit de onderkant van de ketting?
Wat is een organisme dat zijn eigen voedsel voortbrengt uit de onderkant van de ketting?  Welk twee ding omringen elk bewegend elektron?
Welk twee ding omringen elk bewegend elektron?  ATLAS zoekt naar paren Higgs-bosonen in verval van zeldzame deeltjes
ATLAS zoekt naar paren Higgs-bosonen in verval van zeldzame deeltjes Wat zijn de twee basiseenheden van geologische tijdschaal?
Wat zijn de twee basiseenheden van geologische tijdschaal?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

