
Wetenschap
Is aluminium plus chloor een covalente binding?
* elektronegativiteit: Aluminium heeft een elektronegativiteit van 1,61, terwijl chloor een elektronegativiteit van 3,16 heeft. Dit significante verschil in elektronegativiteit betekent dat chloor een veel sterkere aantrekkingskracht heeft voor elektronen.
* elektronenoverdracht: Wanneer aluminium en chloor reageren, krijgen chlooratomen elektronen van aluminiumatomen om een stabiele octetconfiguratie te bereiken. Dit resulteert in de vorming van aluminiumionen (AL3+) en chloride-ionen (Cl-).
* Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen worden vervolgens bij elkaar gehouden door sterke elektrostatische krachten, die een ionische binding vormen.
Belangrijke kenmerken van ionische bindingen:
* Groot elektronegativiteitsverschil tussen elementen
* Elektronenoverdracht van het ene atoom naar het andere
* Vorming van positief geladen kationen en negatief geladen anionen
* Sterke elektrostatische attractie die ionen bij elkaar houdt
Belangrijke kenmerken van covalente bindingen:
* Vergelijkbaar of klein elektronegativiteitsverschil tussen elementen
* Het delen van elektronen tussen atomen
* Vorming van moleculen
Samenvattend, vanwege het grote elektronegativiteitsverschil en elektronenoverdracht tussen aluminium en chloor, is de resulterende binding in aluminiumchloride ionisch, niet covalent.
Hoofdlijnen
- Wetenschappers controleren cellen met licht,
- Te veel charisma kan de effectiviteit van een leider schaden
- Welke wetenschapper zou hoogstwaarschijnlijk de vroegere biosfeer bestuderen?
- Kwallen, geen kaken:onderzoek onthult waar we het meest bang voor zijn in de oceaan
- Zet deze termen in volgorde eiwit DNA-transcriptie vertaling en RNA de stroom van genetische informatie een cel?
- Hoe verschillende soorten organismen bijdragen aan het recyclen van koolstof of stikstof in een ecosysteem?
- Is een massa eencellige plantachtige protisten die in lichaam water leeft?
- Wat is interne kracht in de biomechanica?
- Waarom vissen praten:communicatie met anemoonvissen vestigt status in sociale groepen (met video)
- Nieuwe manier om influenza A-virus te identificeren licht op wanneer specifieke virusdoelen aanwezig zijn
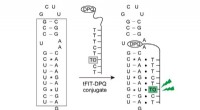
- Nieuwe cyclisatiereacties voor het synthetiseren van macrocyclische medicijnleads

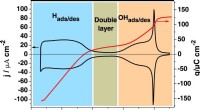
- Nieuw raamwerk past machine learning toe op atomistische modellering

- Nieuw begrip van de belangrijkste brandstofcelkatalysator
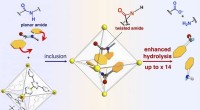
- Een moleculaire snelkookpan maakt taaie stukjes eiwit mals en helpt af te bijten
 Vroege gegevens wijzen op bruisende Amerikaanse vakantieverkopen
Vroege gegevens wijzen op bruisende Amerikaanse vakantieverkopen Afstand tot snelheid en tijd vinden
Afstand tot snelheid en tijd vinden Wat is het oxidatiegetal van ZnHSO32?
Wat is het oxidatiegetal van ZnHSO32?  Wat gebeurt er als u fase gebruikt om te spanning voor een enkel apparaat?
Wat gebeurt er als u fase gebruikt om te spanning voor een enkel apparaat?  De archeebacteriën waren waarschijnlijk de eerste wat?
De archeebacteriën waren waarschijnlijk de eerste wat?  Hoe betrouwbaar zijn zoektermen voor SEO- en SEM-resultaten?
Hoe betrouwbaar zijn zoektermen voor SEO- en SEM-resultaten?  Is een oplosmiddelbase of een zuur?
Is een oplosmiddelbase of een zuur?  Studie synthetiseert wat klimaatverandering betekent voor bosbranden in het noordwesten
Studie synthetiseert wat klimaatverandering betekent voor bosbranden in het noordwesten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


