
Wetenschap
Hoe helpt het weten van oxidatienummer bepalen welke verbindingen het zal vormen?
1. Voorspelling van de chemische formule van verbindingen:
* ionische verbindingen: Oxidatienummers bepalen de verhouding van ionen in een ionische verbinding. Natrium (NA) heeft bijvoorbeeld een oxidatienummer van +1 en chloor (CL) heeft een oxidatienummer van -1. Dit betekent dat ze in een 1:1 -verhouding worden gecombineerd om NaCl (natriumchloride) te vormen.
* Covalente verbindingen: Hoewel covalente verbindingen geen ionen in strikte zin hebben, helpen oxidatienummers de relatieve delen van elektronen en de resulterende elektronegativiteitsverschillen tussen atomen te voorspellen. Dit helpt ons de polariteit van bindingen en de algehele moleculaire structuur te begrijpen.
2. Het type reactie bepalen:
* Redox -reacties: Oxidatienummers zijn van fundamenteel belang voor het begrijpen van redoxreacties. Een toename van het oxidatienummer duidt op oxidatie (verlies van elektronen), terwijl een afname vermindering (versterking van elektronen) aangeeft. Deze kennis is essentieel voor het balanceren van redoxreacties en het voorspellen van de gevormde producten.
3. Inzicht in chemische eigenschappen:
* Reactiviteit: Elementen met hogere oxidatienummers hebben over het algemeen een grotere neiging om te worden verminderd, terwijl elementen met lagere oxidatienummers vatbaarder zijn om te worden geoxideerd. Dit helpt hun reactiviteit te voorspellen in chemische reacties.
* stabiliteit: Oxidatienummers kunnen de stabiliteit van een verbinding aangeven. Elementen in hun meest stabiele oxidatietoestand hebben bijvoorbeeld minder kans om reacties te ondergaan.
4. Identificerende chemische soorten:
* overgangsmetalen: Overgangsmetalen vertonen variabele oxidatietoestanden, wat betekent dat ze meerdere verbindingen kunnen vormen met verschillende oxidatienummers. Hierdoor kunnen we onderscheid maken tussen verschillende chemische soorten van hetzelfde element. Fe (II) (Ferrous) en Fe (III) (Ferric) zijn bijvoorbeeld verschillende vormen van ijzer.
Voorbeeld:
Beschouw het element koolstof. Het kan oxidatienummers hebben, variërend van -4 tot +4. Dit betekent dat het verbindingen zoals methaan (CH4) kan vormen, waar het een oxidatienummer van -4 heeft, of koolstofdioxide (CO2) waar het een oxidatienummer van +4 heeft.
Samenvattend:
Oxidatienummers werken als een krachtig hulpmiddel bij het voorspellen van de verbindingen die een element zal vormen. Ze bieden inzicht in het chemische gedrag, de reactiviteit en de soorten reacties waaraan het zal deelnemen. Door het begrijpen van oxidatienummers kunnen we chemische fenomenen beter voorspellen en verklaren.
 De moleculaire structuur van een bosaroma gedeconstrueerd
De moleculaire structuur van een bosaroma gedeconstrueerd Onderzoekers beschrijven mechanisme achter flagellaire motiliteit
Onderzoekers beschrijven mechanisme achter flagellaire motiliteit Welk type binding vormt wanneer twee atomen zuurstof een molecuul vormen?
Welk type binding vormt wanneer twee atomen zuurstof een molecuul vormen?  Wat is de waarde voor waterdichtheid?
Wat is de waarde voor waterdichtheid?  Wat gebeurt er met het volume vloeistoffen en gassen van vaste stoffen als ze cool zijn?
Wat gebeurt er met het volume vloeistoffen en gassen van vaste stoffen als ze cool zijn?
 Kleurfasen van Northern Cardinals
Kleurfasen van Northern Cardinals Overstromingen kunnen bijna net zo belangrijk zijn als droogte voor toekomstige koolstofboekhouding
Overstromingen kunnen bijna net zo belangrijk zijn als droogte voor toekomstige koolstofboekhouding Dag van de Aarde 2024:Vier effectieve strategieën om voedselverspilling door huishoudens te verminderen
Dag van de Aarde 2024:Vier effectieve strategieën om voedselverspilling door huishoudens te verminderen  Wat zijn de levende wezens die naast elkaar bestaan in een oceaanecosysteem?
Wat zijn de levende wezens die naast elkaar bestaan in een oceaanecosysteem?  Covid-herstel om de uitstoot van alle tijden te verhogen:IEA
Covid-herstel om de uitstoot van alle tijden te verhogen:IEA
Hoofdlijnen
- Waarom pneumokokken vooral mensen treffen
- Welke organel bevat spijsverteringsenzymen en helpen om afval in de cel te verteren?
- Wat is cosidiose?
- Een titerrapport lezen
- Onderzoekers ontdekken hoe CRISPR/Cas vreemd DNA steelt voor het bacteriële immuunsysteem
- Wat is de naam van staafvormige structuur strak opgerold DNA gevonden in celkernplanten en dieren die worden genoemd?
- Anticiperen op toekomstige risico's van klimaatgedreven bosbranden in de boreale bossen
- Welk doel dient schimmels in de levenscyclus van eikenboom?
- Welk deel van een gen draagt de code die wordt gebruikt om eiwitten te maken?
- De kans op succes in de synthetische chemie vergroten
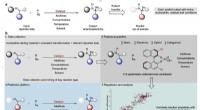
- Gemeenschappelijke herbicideverbinding kan miljoenen levens redden

- Vloeibare metalen printen in driedimensionale structuren

- Nieuw, volledig biologisch afbreekbaar cellulosemembraan blijkt effectief bij olie-waterscheiding

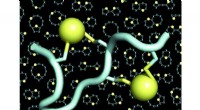
- Dubbelgebrugde peptiden binden elk ziektedoelwit
 Wetenschappers stellen nieuwe selectieve reductieve aminekatalysatoren voor met verbeterde stabiliteit
Wetenschappers stellen nieuwe selectieve reductieve aminekatalysatoren voor met verbeterde stabiliteit Waterstofperoxide afbraak in een cel is functie van?
Waterstofperoxide afbraak in een cel is functie van?  Hoeveel soorten energiegolven zijn er?
Hoeveel soorten energiegolven zijn er?  Wat is het dichtste type korst?
Wat is het dichtste type korst?  Onderzoekers tonen aan dat ionische vloeistoffen effectief zijn voor het voorbehandelen van gemengde mengsels van biobrandstofgrondstoffen
Onderzoekers tonen aan dat ionische vloeistoffen effectief zijn voor het voorbehandelen van gemengde mengsels van biobrandstofgrondstoffen  Wat meet geodesy?
Wat meet geodesy?  Welke fout maakte Einstein in zijn relativiteitstheorie?
Welke fout maakte Einstein in zijn relativiteitstheorie?  Maansteenjager komt dichterbij bij het opsporen van ontbrekende stenen
Maansteenjager komt dichterbij bij het opsporen van ontbrekende stenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

