
Wetenschap
Hoe kun je zien dat een gas halogeen is?
1. Kleur en geur
* Duidelijke kleur: Veel halogenen hebben een karakteristieke kleur in hun gasvormige toestand.
* fluor (f2): Lichtgeelgroen
* chloor (Cl2): Geelgroen
* bromine (BR2): Roodbruin (hoewel het een vloeistof is bij kamertemperatuur, is de damp roodbruin)
* jodium (i2): Violet (hoewel het een vaste stof is bij kamertemperatuur, de damp is violet)
* scherpe geur: Halogenen hebben over het algemeen een sterke, irritante geur.
2. Reactiviteit
* zeer reactief: Halogenen zijn zeer reactieve niet -metalen. Ze vormen gemakkelijk verbindingen met vele andere elementen.
* reactie met metalen: Halogenen reageren met metalen om zouten te vormen (ionische verbindingen). Chloorgas reageert bijvoorbeeld met natrium om natriumchloride te vormen (tafelzout).
* reactie met waterstof: Halogenen reageren met waterstof om waterstofhalogeniden te vormen (bijv. HCl, HBR).
* Bleekeigenschappen: Sommige halogenen, zoals chloor, hebben bleken eigenschappen.
3. Chemische eigenschappen
* Hoge elektronegativiteit: Halogenen hebben een zeer hoge elektronegativiteit, wat betekent dat ze de neiging hebben elektronen aan te trekken in chemische bindingen.
* Oxidatie stelt: Halogenen bestaan meestal in de -1 -oxidatietoestand in combinatie met andere elementen.
4. Locatie op het periodiek systeem
* Groep 17: Halogenen worden gevonden in groep 17 (VIIA) van het periodiek systeem. Ze bevinden zich rechtstreeks rechts van de edelgassen.
Belangrijke opmerking:
* Het is belangrijk om met voorzichtigheid met halogenen om te gaan, omdat ze giftig en corrosief kunnen zijn. Experimenteer nooit met hen zonder de juiste training- en veiligheidsapparatuur.
Laat het me weten als je nog meer vragen hebt!
 Vriendelijke bacteriën centraal:afvalwater behandelen met minder energie en minder uitstoot
Vriendelijke bacteriën centraal:afvalwater behandelen met minder energie en minder uitstoot De Taj Mahal is aan het wegkwijnen, en het kan binnenkort het point of no return bereiken
De Taj Mahal is aan het wegkwijnen, en het kan binnenkort het point of no return bereiken Waarom werd orkaan Patricia zo snel een monster?
Waarom werd orkaan Patricia zo snel een monster?  Opgelost barium als nieuwe kwantitatieve indicator voor Kuroshio-inval in de Oost-Chinese Zee
Opgelost barium als nieuwe kwantitatieve indicator voor Kuroshio-inval in de Oost-Chinese Zee Zijn drukke Amerikaanse steden klaar voor congestieprijzen?
Zijn drukke Amerikaanse steden klaar voor congestieprijzen?
Hoofdlijnen
- Wat hebben de wetenschappers met gegevens na een experiment?
- Aleppo-momenten:wat zorgt ervoor dat onze hersenen onder druk bevriezen?
- Organismen die de zon gebruiken om voedsel te maken?
- Hoe een Silly Putty-ingrediënt stamceltherapieën zou kunnen bevorderen
- Wat zijn biomedische wetenschappen?
- Waarom worden mensen niet beschouwd als goede organismen voor genetische studies?
- Hoe beïnvloeden zowel genen als omgevingen eigenschappen?
- Wat een wetenschapper doet een goed opgeleide gok dat diabetes wordt veroorzaakt door genetische factoren. Zijn voorbeeld van een?
- Zullen cellen met mutaties altijd normale eiwitten maken?
- Voorlopers van zuurchloride maken met behulp van shuttle-katalyse
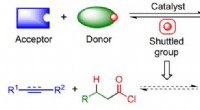
- Onderzoekers beoordelen de snelle vooruitgang in machine learning voor de chemische wetenschappen

- Chemici ontwikkelen een nieuwe manier om antibioticaresistente infecties te behandelen
- Video:Waarom is de lucht aan de westkust oranje?

- Team gebruikt een ernstige vervormingsmethode op bulk magnetische legeringen voor hoge prestaties

 3D-geprinte lithium-ionbatterijen
3D-geprinte lithium-ionbatterijen Wat is een toroidespoel?
Wat is een toroidespoel?  Op welke manier verschilt RNA van DNA?
Op welke manier verschilt RNA van DNA?  Waar haalt de zich ontwikkelende bevruchte eiercel zijn energie vandaan?
Waar haalt de zich ontwikkelende bevruchte eiercel zijn energie vandaan?  Hoe je winnaar kunt worden in het evolutiespel
Hoe je winnaar kunt worden in het evolutiespel  Hoe is taal geëvolueerd?
Hoe is taal geëvolueerd?  Deel je gynaecologische en gehoorgegevens via een Apple research-app op de iPhone?
Deel je gynaecologische en gehoorgegevens via een Apple research-app op de iPhone? Wat is de beste streamingdienst voor jou? Hoe kabelalternatieven zich verhouden voor snoersnijders
Wat is de beste streamingdienst voor jou? Hoe kabelalternatieven zich verhouden voor snoersnijders
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

