
Wetenschap
Hoe verschilt broom van de andere halogenen en niet -metalen?
1. Fysieke toestand:
* broom is een vloeistof bij kamertemperatuur. Dit maakt het uniek onder de halogenen, omdat de andere gassen (fluor, chloor) of vaste stoffen (jodium, astatine) zijn. Deze vloeibare toestand is te wijten aan zijn relatief sterke intermoleculaire krachten (van der Waals -krachten) tussen zijn moleculen.
2. Reactiviteit:
* Bromine is minder reactief dan fluor en chloor, maar reactiever dan jodium. Dit is een algemene trend in de halogenen:reactiviteit neemt af als je de groep afloopt. Dit komt door de afnemende elektronegativiteit van de halogenen in de groep, waardoor ze minder snel elektronen krijgen.
* Bromine is een goed oxidatiemiddel. Het accepteert gemakkelijk elektronen om bromide-ionen (Br-) te vormen, die deelnemen aan verschillende chemische reacties.
3. Uiterlijk en geur:
* Bromine is een roodbruine vloeistof met een scherpe, irritante geur. Het is zeer vluchtig, wat betekent dat het gemakkelijk verdampt in een roodbruin gas. Deze damp is giftig en kan ernstige ademhalingsirritatie veroorzaken.
4. Biologische effecten:
* Bromine is essentieel in sporenhoeveelheden voor sommige biologische processen. Het wordt gevonden in bepaalde enzymen en speelt een rol bij het reguleren van de zenuwfunctie.
* Overtollige broom kan echter giftig zijn. Het kan irritatie veroorzaken in de huid, ogen en ademhalingssysteem.
5. Toepassingen:
* Bromine heeft verschillende industriële toepassingen. Het wordt gebruikt bij de productie van vlamvertragers, pesticiden, geneesmiddelen en desinfectiemiddelen.
* Het wordt ook gebruikt bij de productie van bromide -zouten, die verschillende toepassingen hebben. Deze omvatten fotografie, geneesmiddelen en boorvloeistoffen.
Hier is een vergelijking met andere halogenen en niet -metalen:
* halogenen: Fluor en chloor zijn gassen bij kamertemperatuur, jodium is een vaste stof. Bromine valt op als het enige vloeibare halogeen. Ze vormen allemaal diatomaire moleculen (F2, CL2, BR2, I2) en zijn zeer reactief, maar fluor en chloor zijn het meest reactief.
* niet -metalen: Veel niet -metalen zijn gassen bij kamertemperatuur (bijv. Stikstof, zuurstof, koolstofdioxide). Sommige zijn vaste stoffen (bijv. Koolstof, zwavel, fosfor). Bromine onderscheidt zich als de enige vloeistof niet -metaal.
Conclusie, de unieke fysieke eigenschappen, reactiviteit en toepassingen van Bromine maken het een interessant en belangrijk element. Terwijl het delen van gemeenschappelijke kenmerken met andere halogenen en niet -metalen, onderscheidt de vloeibare toestand bij kamertemperatuur en zijn positie in de reactiviteitsreeks het als een duidelijk en waardevol element.
 Hoe heten de wetenschappers die metalen bestuderen?
Hoe heten de wetenschappers die metalen bestuderen?  Toont CH3COOH waterstof
Toont CH3COOH waterstof  Noem die whisky:colorimetrische herkenning van aldehyden en ketonen
Noem die whisky:colorimetrische herkenning van aldehyden en ketonen Een vereenvoudigd nieuw proces zet houtafval uit landbouw en bosbeheer om in ethanol
Een vereenvoudigd nieuw proces zet houtafval uit landbouw en bosbeheer om in ethanol Hoe cellen hun afvalverwerkingssystemen hergebruiken om ontstekingen te bevorderen
Hoe cellen hun afvalverwerkingssystemen hergebruiken om ontstekingen te bevorderen
 Wat als de VS al hun afval op één gigantische stortplaats zouden gooien?
Wat als de VS al hun afval op één gigantische stortplaats zouden gooien?  Wat is de betekenis van typologie in het milieu?
Wat is de betekenis van typologie in het milieu?  Is er iets uit de natuur dat mensen gebruikten?
Is er iets uit de natuur dat mensen gebruikten?  vulkanisch gruis, watertekort bedreigt bananen van La Palmas
vulkanisch gruis, watertekort bedreigt bananen van La Palmas Overstroming van Parijs grijpt terug op een van de grote doorbraken in de hydrologie
Overstroming van Parijs grijpt terug op een van de grote doorbraken in de hydrologie
Hoofdlijnen
- Hoe natuurbeschermers Merri Creek in Melbourne terugbrachten van vervuiling, verwaarlozing en onkruid
- Wat is een wetenschappelijk mechanisme?
- Wat gebeurt de ademhaling in Organelle?
- Wat is chorofyl?
- Waar zijn stamcellen gevestigd?
- Welke organen zijn betrokken bij homeostase?
- Waar bevindt DNA zich in een multicellulair organisme?
- Chimpansees in het wild passen waarschuwingen aan op basis van wat anderen in hun groep al weten, zo blijkt uit onderzoek
- Wat is het verschil tussen computercel en biologische cel?
- Het opruimen van Tsjernobyl kan worden geholpen door een nieuwe benadering voor röntgenanalyse

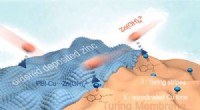
- Turing-membraan om de prestaties van op zink gebaseerde batterijen te verbeteren
- Ruimtepakken beschermen microben die voorbestemd zijn om in de ruimte te leven
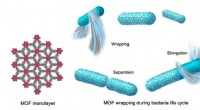
- De dood maakt complexiteit in chemische evolutie mogelijk

- Apparaat gebouwd voor extreme omgevingen kan de productie van Actinium-225 versnellen

 Wat zijn de bronnen van fouten bij het uitvoeren van een laboratoriumexperiment over uniforme cirkelvormige beweging?
Wat zijn de bronnen van fouten bij het uitvoeren van een laboratoriumexperiment over uniforme cirkelvormige beweging?  Wat als onze geschiedenis in grammatica was geschreven?
Wat als onze geschiedenis in grammatica was geschreven?  Wat is het verschil tussen absolute magnitude en helderheid in termen van het meten van de helderheid van hemellichamen?
Wat is het verschil tussen absolute magnitude en helderheid in termen van het meten van de helderheid van hemellichamen?  De overdracht van warmte door de beweging van een vloeistof?
De overdracht van warmte door de beweging van een vloeistof?  Waarom cement de neiging heeft dikker te worden
Waarom cement de neiging heeft dikker te worden  Ambtenaren en kiezers tonen zich na presentaties voor kinderen meer bezorgd over het afval in de oceaan
Ambtenaren en kiezers tonen zich na presentaties voor kinderen meer bezorgd over het afval in de oceaan  Smelt en ijsblokje met zout sneller of suiker?
Smelt en ijsblokje met zout sneller of suiker?  Wat de CIA WikiLeaks-dump ons vertelt:Encryptie werkt
Wat de CIA WikiLeaks-dump ons vertelt:Encryptie werkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

