
Wetenschap
Waarom is ionische verbinding meestal vast en bros bij kamertemperatuur?
1. Sterke elektrostatische krachten:
Ionische verbindingen worden bij elkaar gehouden door sterke elektrostatische krachten tussen tegengesteld geladen ionen. Deze krachten zijn erg sterk en creëren een rigide, driedimensionale roosterstructuur.
2. Bestelde structuur:
De ionen in een ionische verbinding zijn gerangschikt in een sterk geordende, kristallijne structuur. Deze structuur minimaliseert de elektrostatische afstoting tussen ionen van dezelfde lading en maximaliseert de aantrekkingskracht tussen tegengesteld geladen ionen.
3. Gebrek aan gratis elektronen:
Ionische verbindingen hebben geen gratis elektronen. Dit betekent dat ze niet gemakkelijk onder druk kunnen worden vervormd of stromen, omdat er geen mobiele ladingsdragers zijn om beweging te vergemakkelijken.
4. Brosse aard:
Wanneer een externe kracht op een ionisch kristal wordt uitgeoefend, worden de ionen uit hun evenwichtsposities verplaatst. Deze verplaatsing verbreekt de sterke elektrostatische bindingen, wat leidt tot een breuk langs specifieke vlakken van zwakte in het kristalrooster. De brosse aard ontstaat omdat de sterke ionische bindingen zich verzetten tegen buigen of strekken, en de verstoring van deze bindingen leidt tot een plotselinge breuk in plaats van een geleidelijke vervorming.
5. Hoge smelt- en kookpunten:
De sterke elektrostatische krachten tussen ionen vereisen veel energie om te overwinnen, wat resulteert in hoge smelt- en kookpunten voor de meeste ionische verbindingen.
Samenvattend: De sterke elektrostatische krachten tussen ionen, de geordende kristallijne structuur en het ontbreken van vrije elektronen dragen bij aan de vaste, brosse aard van ionische verbindingen bij kamertemperatuur.
 Onderzoekers verbeteren de watersplitsingsreactie voor de productie van groen waterstofgas
Onderzoekers verbeteren de watersplitsingsreactie voor de productie van groen waterstofgas  Wat is de formele lading op zwavelatoom in SO3?
Wat is de formele lading op zwavelatoom in SO3?  Koolhydraten vastleggen
Koolhydraten vastleggen Verbrande botten weer tot leven brengen met behulp van 3D-technologie
Verbrande botten weer tot leven brengen met behulp van 3D-technologie Een student woog 0,550 gram lithiumchloride licl om te gebruiken in een reactie hoeveel mol is dit?
Een student woog 0,550 gram lithiumchloride licl om te gebruiken in een reactie hoeveel mol is dit?
 Bepalen wanneer mensen de planeet op grote schaal begonnen te beïnvloeden
Bepalen wanneer mensen de planeet op grote schaal begonnen te beïnvloeden Tropische storm Pamela verzwakt als landinwaarts over Mexico
Tropische storm Pamela verzwakt als landinwaarts over Mexico Korps versnelt opruiming protestkamp oliepijpleiding
Korps versnelt opruiming protestkamp oliepijpleiding Wat is diversiteit op oppervlakte-niveau?
Wat is diversiteit op oppervlakte-niveau?  Tip de planeet:klimaatverandering aanpakken met kleine, gevoelige interventies
Tip de planeet:klimaatverandering aanpakken met kleine, gevoelige interventies
Hoofdlijnen
- Wilde zwijnengif veldtesten in Texas, Alabama in 2018
- Wat beschrijft het beste de woordhypothese het beste?
- Wat beëindigt een groeiende eiwitketen?
- Wat is moderne landbouw en traditionele landbouw?
- Eerste ontdekking in decennia van blauwe vinvissen nabij de Seychellen
- Wat is het eindresultaat van bemesting in termen van chromosomen -getallen?
- Welke 2 eiwitten worden gebruikt tijdens DNA -replicatie?
- Welke celonderdelen worden alleen aangetroffen in cellen van producenten?
- Welke twee lichaamssystemen werken samen om zuurstof door het lichaam te sturen?
- Bacteriën misleiden om benzeen te hydroxyleren
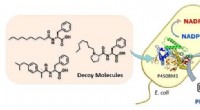
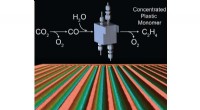
- Efficiënte elektrochemische cellen voor CO2-conversie
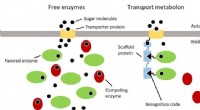
- Efficiënter omgaan met grondstoffen met behulp van moleculaire transportbanden
- Additieve productie en Ni/Ti metalen ondersteuningskoeltechnologie

- Onderzoekers upgraden organische zonnecellen voor gebruik in dakpannen die stroom opwekken
 Canada staat voor enorme verschuiving om klimaatdoelstellingen te halen
Canada staat voor enorme verschuiving om klimaatdoelstellingen te halen Onderzoekers herberekenen efficiëntieparadigma voor dunnefilmzonnepanelen
Onderzoekers herberekenen efficiëntieparadigma voor dunnefilmzonnepanelen Onkruidverdelger veroorzaakt boze verdeeldheid onder Amerikaanse boeren
Onkruidverdelger veroorzaakt boze verdeeldheid onder Amerikaanse boeren Groot-Brittannië beboet Facebook voor datalek (update)
Groot-Brittannië beboet Facebook voor datalek (update) Blanke Amerikanen overschatten raciale vooruitgang nog steeds enorm, studie vondsten
Blanke Amerikanen overschatten raciale vooruitgang nog steeds enorm, studie vondsten Als een zaadkristal aan de oververzadigde oplossing werd toegevoegd, hoe zou u de resulterende oplossing karakteriseren?
Als een zaadkristal aan de oververzadigde oplossing werd toegevoegd, hoe zou u de resulterende oplossing karakteriseren?  Binaire ionische verbinding zink en chloor?
Binaire ionische verbinding zink en chloor?  De snelheid waarmee reacties optreden in een kernreactor wordt gereguleerd door?
De snelheid waarmee reacties optreden in een kernreactor wordt gereguleerd door?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

