
Wetenschap
Waarom is de elektronenconfiguratie voor koper 3D10 4S1 - het is 3D9 4S2?
Dit is waarom:
* stabiliteit van een volledige D-orbital: Een volledig gevulde D-Orbital (D¹⁰) biedt extra stabiliteit. Dit komt door het combineren van elektronen, wat leidt tot lagere energieniveaus en een stabielere configuratie.
* Energieverschil: Hoewel de 4S -orbital over het algemeen als lager in energie wordt beschouwd dan het 3D -orbitaal, kan dit energieverschil klein zijn. In het geval van koper weegt de energie die wordt verkregen door één elektron te promoten van de 4S naar de 3D -orbitaal zwaarder dan het energieverschil, wat leidt tot een stabielere volledige 3D¹⁰ -configuratie.
Denk er op deze manier aan: Het is alsof het hebben van een gevulde doos (3d¹⁰) wenselijker is dan het hebben van een gedeeltelijk gevulde doos (3d⁹) en een volledige doos (4S²), zelfs als de gevulde doos (4S²) iets lager in energie is.
Dit fenomeen, waarbij een enkel elektron wordt verplaatst naar een hoger energieniveau om een gevulde of halfgevulde subschaal te bereiken, is niet uniek voor koper. Het komt ook voor in andere elementen zoals chroom (CR).
Laat het me weten als je nog meer vragen hebt over elektronenconfiguraties!
 Welk milieuorganisme leeft?
Welk milieuorganisme leeft?  Onderzoekers berekenen hun weg naar het middelpunt van de aarde
Onderzoekers berekenen hun weg naar het middelpunt van de aarde De natuur doet ertoe - en het stuurt ons een SOS die we niet langer kunnen negeren
De natuur doet ertoe - en het stuurt ons een SOS die we niet langer kunnen negeren Juridisch respijt slechts tijdelijk als inheemse mijnwerkers uit de Amazone
Juridisch respijt slechts tijdelijk als inheemse mijnwerkers uit de Amazone Waterstof in plaats van elektrificatie? Potenties en risico's voor klimaatdoelen
Waterstof in plaats van elektrificatie? Potenties en risico's voor klimaatdoelen
Hoofdlijnen
- De genen voor de enzymen van glycolyse?
- Wat was er eerst:sociale dominantie of grote hersenen? Wespen kunnen het vertellen
- Ontdekking vergroot het begrip van hoe sommige virussen zich vermenigvuldigen
- Wat is tergazyme?
- Wat is het eindproduct van eiwitten?
- Hagedissen hebben hun koffie ook nodig:kan cafeïne helpen bedreigde soorten terug te brengen van de afgrond?
- Is de nucleolus in zowel planten- als dierlijke cel?
- Hoe kunnen onderzoeken bij ratten van toepassing zijn op mensen?
- Waar staan de letters voor in DNA?
- Unieke moleculaire CODE:paramagnetische codering van moleculen

- Ingenieurs maken de basisbouwsteen voor elektrospun nanovezels
- Fluorescentiepatronen helpen bij medische diagnostiek

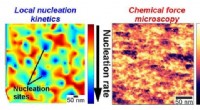
- Nucleatiekinetiek in kaart brengen met nanometerresolutie
- Bundelmers (nieuwe polymeereenheden) kunnen industrieën transformeren

 Welk chromosoom ontwikkelt spieren?
Welk chromosoom ontwikkelt spieren?  Wat absorbeert meer energielampje of donker?
Wat absorbeert meer energielampje of donker?  Waarom is functionele groep een maar geen molecuul?
Waarom is functionele groep een maar geen molecuul?  Wat is een halfwaardetijd en hoe het werd gebruikt om het absolute tijdperk van rots te bepalen?
Wat is een halfwaardetijd en hoe het werd gebruikt om het absolute tijdperk van rots te bepalen?  Wat is de empirische formule van een verbinding die 4,0 g waterstof en 28 stikstof bevat?
Wat is de empirische formule van een verbinding die 4,0 g waterstof en 28 stikstof bevat?  Is Quarts of Quartz een rotsmineraal?
Is Quarts of Quartz een rotsmineraal?  Welk soort mutatie heeft het grotere potentieel om de evolutie een populatiebodycel of in een eiercel te beïnvloeden?
Welk soort mutatie heeft het grotere potentieel om de evolutie een populatiebodycel of in een eiercel te beïnvloeden?  Nieuwe ontdekking verbetert het gebruik van optische pincetten
Nieuwe ontdekking verbetert het gebruik van optische pincetten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

