
Wetenschap
Wat is de effectieve nucleaire lading die valentie -elektronen ervaren?
factoren die Zeff beïnvloeden:
* Aantal kernelektronen: Hoe meer kernelektronen er zijn, hoe groter het afschermingseffect, resulterend in een lagere Zeff.
* Hoofdkwantumnummer (n) van het valentie -elektron: Elektronen in hogere energieniveaus (grotere N) ervaren een zwakkere Zeff omdat ze verder van de kern zijn en effectiever worden afgeschermd door de kernelektronen.
* Elektronenconfiguratie: Elektronen in subshells met een hoger azimutaal kwantumnummer (L) worden effectiever afgeschermd, wat resulteert in een lagere Zeff.
Berekening van Zeff:
Zeff kan worden geschat met behulp van de regels van Slater, die een reeks empirische constanten bieden om het afschermingseffect te verklaren.
gevolgen van Zeff:
* Atomische straal: Hogere Zeff leidt tot een kleinere atoomradius terwijl de valentie -elektronen dichter bij de kern worden getrokken.
* ionisatie -energie: Hogere Zeff leidt tot een hogere ionisatie -energie omdat het meer energie vereist om een valentie -elektron te verwijderen.
* elektronegativiteit: Hogere Zeff leidt tot hogere elektronegativiteit omdat het atoom een sterkere aantrekkingskracht heeft op elektronen.
* Chemische reactiviteit: Zeff speelt een belangrijke rol bij het bepalen van de chemische reactiviteit van een element.
Voorbeeld:
Overweeg natrium (NA), die 11 protonen (z =11) heeft en een elektronische configuratie van 1S²2S²2P⁶3S¹. Het valentie -elektron in de 3s orbitale ervaart een Zeff van ongeveer +1, vanwege het afschermingseffect van de 10 kernelektronen.
Samenvattend is de effectieve nucleaire lading die wordt ervaren door valentie -elektronen een sleutelfactor die verschillende atoom- en chemische eigenschappen beïnvloedt.
 Hoe vakantiefoto's van zebra's en walvissen kunnen bijdragen aan natuurbehoud
Hoe vakantiefoto's van zebra's en walvissen kunnen bijdragen aan natuurbehoud  Rapport:Amerikaanse vloedgolven twee keer zo hoog als 30 jaar geleden
Rapport:Amerikaanse vloedgolven twee keer zo hoog als 30 jaar geleden Nord Stream lekte minder methaan dan gevreesd:atmosferische monitor
Nord Stream lekte minder methaan dan gevreesd:atmosferische monitor Ontwikkelingslanden helpen zich aan te passen aan klimaatverandering
Ontwikkelingslanden helpen zich aan te passen aan klimaatverandering VK belooft uitstoot van 68 procent te verminderen tegen het einde van het decennium
VK belooft uitstoot van 68 procent te verminderen tegen het einde van het decennium
Hoofdlijnen
- Welk bioom bevat planten en dieren die zijn aangepast om water te besparen?
- Wat is een chromosomale mutatie?
- Hoe krijg je chloride-ionen in de cel
- Wat zijn stamcellen en waarvoor worden ze gebruikt?
- Wat is de functie van een transportsysteem in het levende organisme?
- Hoe noem je een embryo tijdens de late stadia van ontwikkeling?
- Wat is de natuurlijke formule van de mens?
- Wetenschappers ontdekken hoe bepaalde hormonen aspecten van de wortelvertakking in planten controleren
- Op welke manieren zijn de bloemen vergelijkbaar met het reproductieve systeem van dieren?
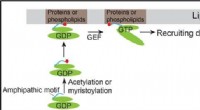
- Onderzoekers ontdekken een nieuw mechanisme voor het werven van ARF-familie-eiwitten
- Geometrisch verbijsterende quasikristallen gevonden in het puin van de allereerste nucleaire explosie

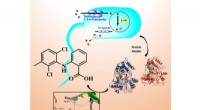
- Nieuwe antibacteriële geneesmiddelen ontwikkeld aan de Universiteit van Oost-Finland
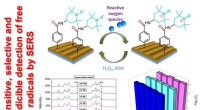
- Wetenschappers maken sensoren met vallen voor vrije radicalen
- Onderzoeker meldt dat de manier waarop sikkelcellen worden gevormd de sleutel kan zijn om ze te stoppen

 Centrumrechtse Europarlementariërs waren minder samenhangend bij stemmingen over fundamentele waarden van de EU tijdens Fidesz-tijdperk, studie toont
Centrumrechtse Europarlementariërs waren minder samenhangend bij stemmingen over fundamentele waarden van de EU tijdens Fidesz-tijdperk, studie toont Wat zijn enkele moleculen die bewegen door diffusie en osmose?
Wat zijn enkele moleculen die bewegen door diffusie en osmose?  Wat reist de maan rond 27 dagen en 7 uur?
Wat reist de maan rond 27 dagen en 7 uur?  Natuurkundigen onderzoeken hoe de tijd vooruitgaat
Natuurkundigen onderzoeken hoe de tijd vooruitgaat  Cheetah III-robot bereidt zich voor op een rol als eerstehulpverlener
Cheetah III-robot bereidt zich voor op een rol als eerstehulpverlener Waarom wordt rubber gebruikt om elektrische draden te maken?
Waarom wordt rubber gebruikt om elektrische draden te maken?  Is energie de capaciteit om een duw aan te brengen of een object te trekken?
Is energie de capaciteit om een duw aan te brengen of een object te trekken?  Mercedes wil in 2039 van verbrandingsmotoren af
Mercedes wil in 2039 van verbrandingsmotoren af
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

