
Wetenschap
Wat is de vergelijking voor gesmolten aluminiumchloride geëlektolyseerd?
kathode:
Al³⁺ (l) + 3e⁻ → al (l)
anode:
2cl⁻ (l) → cl₂ (g) + 2e⁻
Algemene reactie:
2alcl₃ (l) → 2al (l) + 3cl₂ (g)
Verklaring:
* gesmolten aluminiumchloride: Het uitgangsmateriaal is gesmolten aluminiumchloride, een vloeistof bij hoge temperaturen.
* elektrolyse: Dit proces omvat het passeren van een elektrische stroom door het gesmolten zout.
* kathode: De kathode is de negatieve elektrode waar reductie optreedt. Aluminiumionen (AL³⁺) krijgen elektronen en worden gereduceerd tot vloeibaar aluminium metaal.
* anode: De anode is de positieve elektrode waar oxidatie optreedt. Chloride -ionen (CL⁻) verliezen elektronen en worden geoxideerd tot chloorgas.
belangrijke opmerkingen:
* De elektrolyse van gesmolten aluminiumchloride is een commercieel belangrijk proces voor het produceren van aluminiummetaal.
* Het proces vereist een hoge temperatuur (ongeveer 1000 ° C) om het aluminiumchloride gesmolten te houden.
* Het chloorgas geproduceerd als een bijproduct kan worden gebruikt in andere industriële processen.
 Hoe zijn bossen nuttig voor dieren?
Hoe zijn bossen nuttig voor dieren?  Verbied plastic om het erfgoed van 's werelds oudste en grootste bewoonde riviereiland te redden
Verbied plastic om het erfgoed van 's werelds oudste en grootste bewoonde riviereiland te redden Geowetenschappers gebruiken zirkoon om de oorsprong van de continenten van de aarde te traceren
Geowetenschappers gebruiken zirkoon om de oorsprong van de continenten van de aarde te traceren "Life Cycle of Pythium
"Life Cycle of Pythium Wat veroorzaakt troposferische ozonvervuiling boven het noordelijke Tibetaanse plateau?
Wat veroorzaakt troposferische ozonvervuiling boven het noordelijke Tibetaanse plateau?
Hoofdlijnen
- Een fosfolipideroute van planten naar parasieten
- Waar zijn giste en suboptimale voorbeelden van?
- Welke protisten gebruiken sporen om zich voort te planten?
- Wat zijn de kenmerken van aseksuele reproductie?
- Begrijpen waarom BRCA2 verband houdt met het risico op kanker
- Zijn alle leden van Kingdom Fungi veel cellen gemaakt?
- Datawetenschap onthult universele regels voor het vormgeven van cellen in elektriciteitscentrales
- Fruitvliegonderzoek kan onthullen wat er in de hersenen van vrouwen gebeurt tijdens verkering en paring
- Wat betekent zeggen dat een cel ontplooiing is?
- Korte totale synthese van ajoen, een biologisch actieve component in olie-extracten van knoflook
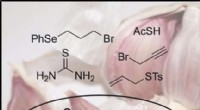
- Frontale polymerisatie afstemmen op diverse materiaaleigenschappen
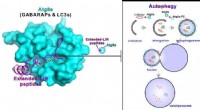
- Wetenschappers ontdekken autofagieremmende peptiden van gigantische ankyrinen
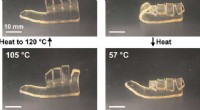
- Warme melk maakt je slaperig - peptiden kunnen verklaren waarom

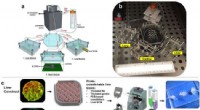
- Wetenschappers ontwikkelen body-on-a-chip-systeem om het testen van nieuwe medicijnen te versnellen
 Identificeer twee energiebronnen die generatoren gebruiken om elektriciteit te creëren?
Identificeer twee energiebronnen die generatoren gebruiken om elektriciteit te creëren?  Hoe verhouden de planeten zich tot seizoenen?
Hoe verhouden de planeten zich tot seizoenen?  Natuurkundigen creëren een nieuwe klasse van 2D kunstmatige materialen
Natuurkundigen creëren een nieuwe klasse van 2D kunstmatige materialen Wat is de relatie tussen een chromosoom en een allel?
Wat is de relatie tussen een chromosoom en een allel?  Hoe brengen elektromagnetische golven energie over om er toe te doen?
Hoe brengen elektromagnetische golven energie over om er toe te doen?  Gene Cernan, laatste astronaut die op de maan liep, sterft op 82 (update)
Gene Cernan, laatste astronaut die op de maan liep, sterft op 82 (update) Hebben dieren en planten cellen nucleoïde regio?
Hebben dieren en planten cellen nucleoïde regio?  Wil je de toeristische hordes van Europa vermijden? Probeer buiten de gebaande paden te treden
Wil je de toeristische hordes van Europa vermijden? Probeer buiten de gebaande paden te treden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

