
Wetenschap
Ionen van de elementen zuurstof (O) zwavel (s) en selenium (SE) hebben meestal ladingen -2. Fluor (F) chloor (CL) broom (Br) -1.?
Dit is waarom:
* zuurstof (O), zwavel (s) en selenium (SE): Deze elementen bevinden zich allemaal in groep 16 van de periodieke tabel (ook bekend als de chalcogenen). Ze hebben de neiging om twee elektronen te krijgen om een stabiele, edelgaselektronenconfiguratie te bereiken. Dit resulteert in een -2 -lading.
* fluor (f), chloor (CL) en broom (Br): Deze elementen zijn in groep 17 (ook bekend als de halogenen). Ze hebben de neiging om één elektron te krijgen om een stabiele, edelgaselektronenconfiguratie te bereiken, wat leidt tot een -1 -lading.
Sleutelpunt: De neiging om ionen te vormen met specifieke ladingen is direct gerelateerd aan hun positie in het periodiek systeem en hun wens om een stabiele elektronenconfiguratie te bereiken, zoals het dichtstbijzijnde edelgas.
 Wat is de opgeloste stof en het oplosmiddel voor terpentijn?
Wat is de opgeloste stof en het oplosmiddel voor terpentijn?  Een nieuw textielmateriaal dat zichzelf kiemvrij houdt
Een nieuw textielmateriaal dat zichzelf kiemvrij houdt Onderzoekers stroomlijnen moleculaire assemblagelijn om te ontwerpen, test medicijnverbindingen
Onderzoekers stroomlijnen moleculaire assemblagelijn om te ontwerpen, test medicijnverbindingen Wat is de literatuurwaarde van KB voor H2O?
Wat is de literatuurwaarde van KB voor H2O?  Zou een zwavel positief ion worden voordat hij zich bindt?
Zou een zwavel positief ion worden voordat hij zich bindt?
 Wedden op speculatieve geo-engineering kan een escalerende klimaatschuldencrisis riskeren
Wedden op speculatieve geo-engineering kan een escalerende klimaatschuldencrisis riskeren Wat is 7 principes van de omgeving?
Wat is 7 principes van de omgeving?  Earth-monitoring Landsat 9-satelliet gelanceerd in Californië
Earth-monitoring Landsat 9-satelliet gelanceerd in Californië NASA ziet tropische cycloon Josie ten zuiden van Fiji . kruipen
NASA ziet tropische cycloon Josie ten zuiden van Fiji . kruipen Waarom vallen objecten naar het centrum van de aarde?
Waarom vallen objecten naar het centrum van de aarde?
Hoofdlijnen
- Hoeveel cellen zitten er in een honingbijenframe?
- Wat zijn de kenmerken van DNA?
- Wat zijn enkele overeenkomsten van DNA en RNA?
- Hoe vertalen nucleotiden zich in aminozuren?
- Welk enzym gebruiken wetenschappers om genen uit DNA uit strengen te snijden?
- Wat betekent de term onafhankelijke assortiment van allelen bij gebruik in contextgenetica?
- Dode vissen en depressies aan de oevers van de Oder
- Trofeejacht kan uitsterven veroorzaken in een veranderende omgeving
- Wat zijn enkele biotische factoren in het waterbioom?
- Onderzoekers brengen eiwitbeweging in kaart
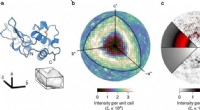
- Nieuwe verbindingen uit de zeester van het Kuril-bekken tonen werkzaamheid tegen kankercellen.

- Beoordeling van de overleving in de lucht van bacteriën in aerosoldruppels van hoesten en niezen

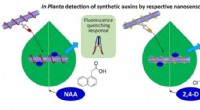
- Onderzoekers ontwerpen sensoren om plantenhormonen snel te detecteren
- Wetenschappers ontwikkelen een efficiënte manier om goedkope koellichamen te produceren

 Wat is een diagram dat door biologen wordt gebruikt om de uitkomst van het genetische kruis te voorspellen?
Wat is een diagram dat door biologen wordt gebruikt om de uitkomst van het genetische kruis te voorspellen?  Duitsland bereikt klimaatdoel dankzij pandemie
Duitsland bereikt klimaatdoel dankzij pandemie Wat is 70 Fahrenheit in graden Celsius?
Wat is 70 Fahrenheit in graden Celsius?  Waarom een verrassende ontdekking, de opwarming van de zeeën en de ondergang van 'Meg' voor meer haaien problemen kunnen opleveren
Waarom een verrassende ontdekking, de opwarming van de zeeën en de ondergang van 'Meg' voor meer haaien problemen kunnen opleveren  Hoe kunnen parasieten hun gastheren herkennen?
Hoe kunnen parasieten hun gastheren herkennen?  Hoe heeft thermische energie uw economie effect?
Hoe heeft thermische energie uw economie effect?  Wat betekent kosmologisch?
Wat betekent kosmologisch?  Nieuw bioremediatiemateriaal kan chemicaliën voor altijd reinigen
Nieuw bioremediatiemateriaal kan chemicaliën voor altijd reinigen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

