
Wetenschap
Wat is de pH van een 4,3 x 10-2 M HCl-oplossing?
Inzicht in de concepten
* HCl is een sterk zuur: Dit betekent dat het volledig ioniseert in water, wat betekent dat alle HCL -moleculen uit elkaar breken in H⁺ -ionen en Cl⁻ -ionen.
* pH is een maat voor zuurgraad: Hoe lager de pH, hoe zuurder de oplossing. De pH -schaal varieert van 0 tot 14, waarbij 7 neutraal zijn.
Berekeningen
1. Vind de concentratie van H⁺ -ionen: Omdat HCl een sterk zuur is, is de concentratie van H⁺ -ionen gelijk aan de initiële concentratie van HCl:
[H⁺] =4,3 x 10⁻² m
2. Gebruik de pH -formule:
pH =-log [H⁺]
3. Sluit de waarde aan en bereken:
pH =-log (4,3 x 10⁻²)
pH ≈ 1.37
Daarom is de pH van een 4,3 x 10⁻² M HCl -oplossing ongeveer 1,37.
 Wat gebeurt er met de druk als de temperatuur van een gas wordt verlaagd?
Wat gebeurt er met de druk als de temperatuur van een gas wordt verlaagd?  Wat is een vloeistof die op glas condenseert als je het inademt?
Wat is een vloeistof die op glas condenseert als je het inademt?  Hoe kan men bepalen of een reactie endotherm of exotherm is in een calorimetrisch experiment?
Hoe kan men bepalen of een reactie endotherm of exotherm is in een calorimetrisch experiment?  Recycling geeft nieuwe bestemming aan verbruikte splijtstof
Recycling geeft nieuwe bestemming aan verbruikte splijtstof Waarom weegt het natriumhydroxide in een fles en niet op een stuk filtreerpapier?
Waarom weegt het natriumhydroxide in een fles en niet op een stuk filtreerpapier?
 Groene droom:kan de VN-top het klimaatprobleem nieuw leven inblazen?
Groene droom:kan de VN-top het klimaatprobleem nieuw leven inblazen?  Schijnbare Atlantische opwarmingscyclus waarschijnlijk een artefact van klimaatforcering
Schijnbare Atlantische opwarmingscyclus waarschijnlijk een artefact van klimaatforcering Verschil tussen een mannelijke mug en een kraan Fly
Verschil tussen een mannelijke mug en een kraan Fly Wetenschappers ontwikkelen goedkoop overstromingsdetectiesysteem
Wetenschappers ontwikkelen goedkoop overstromingsdetectiesysteem De wateren testen:de impact van hydrofracturering op waterdieren beoordelen
De wateren testen:de impact van hydrofracturering op waterdieren beoordelen
Hoofdlijnen
- Nucleus: definitie, structuur en functie (met diagram)
- Kraaien en keapapegaaien blijken het nut van objecten te leren, vergelijkbaar met de manier waarop menselijke baby's het doen
- Geef een voorbeeld van gevolgtrekking en observatie?
- Welke zijn meer geconserveerde DNA- of eiwitsequentie?
- Onderzoekers ontdekken verschillende levenscyclusfasen van de ectosymbiotische DPANN-archaeon Nanobdella aerobiophila
- Ontwikkeling nabootsen in een petrischaaltje om te begrijpen hoe planten leven
- De chemische samenstelling van voedingsstoffen Agar
- Wat bestaat uit de mutualistische relatie een schimmel en algen of autotrofe bacteriën?
- De manier waarop een organisme op een stimulus reageert, resulteert vaak in wat?
- Wat is pepperspray?

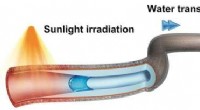
- Snel gecontroleerd transport van waterdruppels door door zonlicht aangedreven pomp
- Wetenschappers onthullen aard van geometrische fase-effecten in ultrakoude chemische reacties
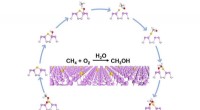
- Goud-fosfor-nanobladen katalyseren selectief aardgas tot groenere energie
- Een potentieel goedkope, efficiënt en milieuvriendelijk systeem voor het zuiveren van aardgas

 Wat heeft de bovenste grond?
Wat heeft de bovenste grond?  Welke witte stoffen vormen vorst?
Welke witte stoffen vormen vorst?  Wat is een experiment dat u kunt doen om het drijfvermogen te testen?
Wat is een experiment dat u kunt doen om het drijfvermogen te testen?  Geeft een stoomturbine warmte -energie om in kinetische energie?
Geeft een stoomturbine warmte -energie om in kinetische energie?  Ultradunne cameralenzen van de toekomst kunnen het daglicht zien
Ultradunne cameralenzen van de toekomst kunnen het daglicht zien Welke planeet draait het snelst rond de zon?
Welke planeet draait het snelst rond de zon?  Interessante feiten over plantencellen
Interessante feiten over plantencellen  Historische hittegolf ontploft in het noordwesten terwijl het risico op bosbranden toeneemt
Historische hittegolf ontploft in het noordwesten terwijl het risico op bosbranden toeneemt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

