
Wetenschap
Wat is de pH voor natriumnitriet?
Dit is waarom:
* Hydrolyse: Wanneer natriumnitriet oplost in water, dissocieert het in natriumionen (Na⁺) en nitrietionen (NO₂) ⁻. De nitrietionen reageren met watermoleculen om stikstofzuur (HNO₂) en hydroxide -ionen (OH⁻) te vormen.
* Basisvorming: De geproduceerde hydroxide -ionen verhogen de pH van de oplossing, waardoor het basic is.
De exacte pH van een natriumnitrietoplossing hangt af van de concentratie ervan. Hogere concentraties zullen resulteren in een meer basale pH.
Het is echter belangrijk op te merken dat:
* Natriumnitriet is een giftige stof en moet met zorg worden behandeld.
* De pH van natriumnitrietoplossingen kan worden berekend met behulp van geschikte chemische vergelijkingen en evenwichtsconstanten.
Om de exacte pH voor een specifieke natriumnitrietoplossing te bepalen, moet u de concentratie ervan kennen en de juiste chemische evenwichtsuitdrukkingen gebruiken.
Hoofdlijnen
- Welke rol spelen mutaties bij natuurlijke selectie?
- Haaienaanvallen nemen wereldwijd toe, zegt onderzoek:hoe vaak komen ze voor in Californië?
- Wetenschappers ontdekken de basisprincipes van hoe drukgevoelige piëzo-eiwitten werken
- Wetenschappers visualiseren hoe bacteriën met elkaar praten
- Wat is een andere naam voor wetenschappelijke gok?
- Wetenschappers ontdekken hoe rapamycine de celgroei vertraagt
- Inactiviteit van Nieuw-Zeeland tegen bijvangst van schildpadden in de visserij riskeert reputatieschade—leatherbacks zijn nu bijna uitgestorven
- Wat zijn voorbeelden van wetenschappelijke conclusies?
- Welke term beschrijft binnenvallende bacterievirussen en parasieten?
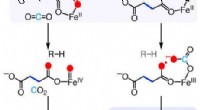
- Onderzoekers onthullen spannende nieuwe manier om farmaceutische ingrediënten goedkoper en veiliger te produceren
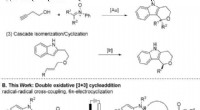
- De route voor de productie van ethyleen
- Praktische oplossing voor het voorkomen van corrosieve opbouw in nucleaire systemen

- Een vreemd fenomeen ontrafelen dat zowel de prestaties van lithium-ionbatterijen helpt als schaadt

- Poreus silica beschermt de nikkelkatalysator
 Economie gebruiken om de verstrekkende gevolgen van het ongedaan maken van Roe v. Wade te begrijpen
Economie gebruiken om de verstrekkende gevolgen van het ongedaan maken van Roe v. Wade te begrijpen Beroemde zwarte ingenieurs door de geschiedenis heen
Beroemde zwarte ingenieurs door de geschiedenis heen  Staat de zon in het midden van een kometenbaan?
Staat de zon in het midden van een kometenbaan?  Systeem transformeert 3D-structuur van een eiwit in een 2D-contactkaart
Systeem transformeert 3D-structuur van een eiwit in een 2D-contactkaart Uit onderzoek blijkt dat ongewervelde dieren een cruciale rol spelen als eco-beheerders in de mondiale afbraak van bosafval
Uit onderzoek blijkt dat ongewervelde dieren een cruciale rol spelen als eco-beheerders in de mondiale afbraak van bosafval  De rol van de ESA's bij het verminderen van waterschaarste
De rol van de ESA's bij het verminderen van waterschaarste Suomi NPP vindt ongeorganiseerde stormen in tropische depressie 29W
Suomi NPP vindt ongeorganiseerde stormen in tropische depressie 29W Gedraagt salpeterzuur zich als base?
Gedraagt salpeterzuur zich als base?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


