
Wetenschap
Hoe verklaart u de waargenomen oplosbaarheid van naftaleen en natriumchloride in waterether op basis van natuurbindingen die ze bestaan?
naftaleen (c₁₀h₈)
* Structuur: Naftaleen is een niet -polaire koolwaterstof met een vlakke structuur bestaande uit twee gesmolten benzeenringen.
* bindingen: Het wordt bij elkaar gehouden door sterke covalente bindingen in het molecuul, maar deze zijn niet -polair vanwege de vergelijkbare elektronegativiteit van koolstof en waterstof.
* Oplosbaarheid:
* water (h₂o): Water is een zeer polair oplosmiddel vanwege de aanwezigheid van waterstofbruggen tussen zijn moleculen. De niet -polaire aard van naftaleen leidt tot slechte interactie met watermoleculen. Daarom is het onoplosbaar in water .
* Diethylether (ch₃ch₂och₂ch₃): Diethylether is een minder polair oplosmiddel dan water. Het heeft ook een niet -polaire koolwaterstofketen, waardoor het kan interageren met de niet -polaire structuur van naftaleen door dispersiekrachten in Londen . Dit maakt naftaleen oplosbaar in diethylether .
Natriumchloride (NaCl)
* Structuur: Natriumchloride is een ionische verbinding bestaande uit na⁺kationen en cl⁻ -anionen die bij elkaar worden gehouden door sterke elektrostatische attracties.
* bindingen: Ionische bindingen bestaan tussen de natrium- en chloride -ionen.
* Oplosbaarheid:
* water (h₂o): Met de hoge polariteit en het vermogen van water om waterstofbruggen te vormen, kunnen het de ionen in NaCl effectief oplossen. De gedeeltelijke negatieve ladingen op zuurstof in watermoleculen trekken de natriumionen aan, terwijl de gedeeltelijke positieve ladingen op waterstof de chloride -ionen aantrekken. Deze interactie breekt het ionische rooster en leidt tot oplossen van NaCl in water .
* Diethylether (ch₃ch₂och₂ch₃): Diethylether is een niet -polair oplosmiddel. Het kan de sterke elektrostatische krachten niet overwinnen die de natrium- en chloride -ionen bij elkaar houden. Als gevolg hiervan is NaCl onoplosbaar in diethylether .
Key Takeaways:
* "zoals oplost zoals" principe: Polaire stoffen lossen in polaire oplosmiddelen op en niet -polaire stoffen lossen op in niet -polaire oplosmiddelen.
* intermoleculaire krachten: Het type en de sterkte van intermoleculaire krachten (waterstofbinding, dipool-dipoolinteracties, dispersiekrachten in Londen) beïnvloeden de oplosbaarheid.
Laat het me weten als je nog meer vragen hebt!
 Mineralen zijn substantie samengesteld uit twee of meer elementen die in duidelijke verhoudingen aan elkaar zijn verbonden?
Mineralen zijn substantie samengesteld uit twee of meer elementen die in duidelijke verhoudingen aan elkaar zijn verbonden?  Hoe wordt de kaliniteit van de temperatuur en stromingen van watereffect?
Hoe wordt de kaliniteit van de temperatuur en stromingen van watereffect?  Nieuwe verbindingen met gesynthetiseerde anticarcinogene verbindingen
Nieuwe verbindingen met gesynthetiseerde anticarcinogene verbindingen Wat is anorganische colloïde?
Wat is anorganische colloïde?  Hoeveel mol C6H6 zijn er in 195G C6H6?
Hoeveel mol C6H6 zijn er in 195G C6H6?
 Satellietgegevens helpen stadswarmte te verminderen
Satellietgegevens helpen stadswarmte te verminderen Wat eet Boxelder-bugs?
Wat eet Boxelder-bugs?  Toevallige vondst heeft grote gevolgen voor de kosten van waterbehandelingen en de ecologische voetafdruk
Toevallige vondst heeft grote gevolgen voor de kosten van waterbehandelingen en de ecologische voetafdruk De verrassende reden waarom sommige lemuren gevoeliger zijn voor bosverlies
De verrassende reden waarom sommige lemuren gevoeliger zijn voor bosverlies  Wat is een voorbeeld van kwalitatief eigendom?
Wat is een voorbeeld van kwalitatief eigendom?
Hoofdlijnen
- Welke rol spelen mutaties bij natuurlijke selectie?
- Hoe is de associatie tussen algen en schimmels gunstig voor elkaar?
- Wat is de vrouwelijke gameet?
- Het drie domeinenysteem ontstond toen wetenschappers organismen gegroepeerd hebben op basis van hoe lang ze zijn geweest?
- De 3 regels voor het benoemen van organismen waren?
- Welke antigenen zijn er in een menselijk lichaam?
- Hoe regenereert de huid?
- Wat is de specifieke naam van het eiwitkanaal dat ATP maakt?
- Welke mRNA-codons zullen het translatieproces starten?
- Wetenschappers hebben nieuwe verbindingen met mogelijk antitumoreffect verkregen uit zeespons

- Moleculaire kristalstructuren verpakken het in
- Plastic-etende enzymcocktail luidt nieuwe hoop in voor plastic afval

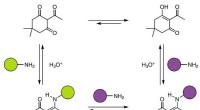
- Chemici maken thermohardend polymeer met behulp van amine en triketon dat recyclebaar is
- Kunststoffen zijn niet wat we denken. Nieuwe studie vindt dat ze een beetje rubberachtig zijn, de weg vrijmaken voor betere producten

 Is het filteren van koffie een fysieke of chemische verandering?
Is het filteren van koffie een fysieke of chemische verandering?  Snelwegen in Brazilië zorgen voor ontwikkeling en vernietiging van Amazone
Snelwegen in Brazilië zorgen voor ontwikkeling en vernietiging van Amazone Wat is een vouw in de aardkorst?
Wat is een vouw in de aardkorst?  Nieuwe studie onthult hoe veranderingen in de regenval op Mars de planeet hebben gevormd
Nieuwe studie onthult hoe veranderingen in de regenval op Mars de planeet hebben gevormd Hoeveel krachten zijn nodig voor een enkele interactie?
Hoeveel krachten zijn nodig voor een enkele interactie?  Koudste temperatuur op het noordelijk halfrond officieel bevestigd
Koudste temperatuur op het noordelijk halfrond officieel bevestigd Wat is een interessant feit over de Yukon -rivier?
Wat is een interessant feit over de Yukon -rivier?  Hoe verandert elektriciteit van de ene transformator naar de andere?
Hoe verandert elektriciteit van de ene transformator naar de andere?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

