
Wetenschap
Wat is er reactiever dan natrium?
reactiviteit in chemie
* metalen: Metalen verliezen de neiging elektronen te verliezen om positieve ionen (kationen) te vormen. Hoe gemakkelijker het is voor een metaal om elektronen te verliezen, hoe reactiever het is.
* Elektrochemische serie: De elektrochemische serie rangschikt metalen op basis van hun neiging om elektronen te verliezen. Metalen hoger op de serie zijn reactiever.
Elementen die reactiever zijn dan natrium
Natrium (NA) is een zeer reactief alkalimetaal, maar verschillende elementen zijn nog reactiever:
* kalium (k): Kalium zit boven natrium in de elektrochemische serie. Het reageert krachtiger met water en zuurstof.
* lithium (li): Lithium is het lichtste alkalimetaal en ook zeer reactief. Het is echter minder reactief dan kalium.
* rubidium (RB) en cesium (CS): Deze alkali -metalen zijn nog reactiever dan kalium. Ze reageren explosief met water en lucht.
Waarom is dit zo?
De reactiviteit van alkali -metalen neemt toe naarmate je de groep in het periodiek systeem afloopt. Dit komt door:
* Verhogende atoomgrootte: Terwijl je de groep afloopt, is het buitenste elektron verder van de kern en minder sterk aangetrokken. Dit maakt het gemakkelijker om het elektron te verwijderen en het element reactiever.
* Afnemende ionisatie -energie: De ionisatie -energie is de energie die nodig is om een elektron te verwijderen. Naarmate de atoomgrootte toeneemt, neemt de ionisatie -energie af, waardoor het gemakkelijker is om een elektron te verliezen.
Belangrijke opmerking: Het omgaan met zeer reactieve metalen zoals kalium, rubidium en cesium vereist extreme voorzichtigheid vanwege hun potentieel voor gewelddadige reacties.
Hoofdlijnen
- Wat is een FLASK-definitie?
- Wat zijn de deelnemers aan fotosynthese?
- Tijger botten? Leeuw botten? Een bijna uitgestorven cycad? DNA-controles ter plaatse bij aankomsthavens
- AI kan onderzoekers helpen begrijpen wat virussen van plan zijn in de oceanen en in uw darmen
- De Europese wisent kan zich goed aanpassen aan het mediterrane klimaat van Zuid-Spanje, zo blijkt uit analyse
- Wat is een andere naam voor Galvanic Cell?
- Wat is een symbiotische relaties Wat betekent elk?
- Wat is een voorbeeld van een biogedicht?
- Worden wetenschappelijke ontdekkingen aangestuurd door geweldige individuen of teams?
- Chemische verbindingen in voedingsmiddelen kunnen een belangrijk SARS-CoV-2-enzym remmen

- Nieuwe chemie voor het regelen van het vloeistofvolume in volumetrische additieve productie
- Wat een kristal onthult over de verwerking van nucleair materiaal

- Nieuw materiaal voor katholieten en anolieten in organische redoxflow-batterijen

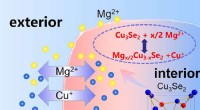
- Koperion ontsluit magnesiumpotentieel in batterijen van de volgende generatie
 Hoe zijn zonovergoten en prominente verschillen anders?
Hoe zijn zonovergoten en prominente verschillen anders?  Chemici ontwikkelen een nieuwe methode om gefluoreerde componenten in moleculen te introduceren
Chemici ontwikkelen een nieuwe methode om gefluoreerde componenten in moleculen te introduceren  Welk zout wordt vaak gebruikt in bakkerijproducten?
Welk zout wordt vaak gebruikt in bakkerijproducten?  Gereedschapspadoptimalisatie maakt snelle gereedschapsservobewerking met nanometerprecisie mogelijk
Gereedschapspadoptimalisatie maakt snelle gereedschapsservobewerking met nanometerprecisie mogelijk Gebruikt iemand zonne -energie?
Gebruikt iemand zonne -energie?  Wat moet er gebeuren voordat een object dat al in beweging is, zijn snelheid of richting verandert?
Wat moet er gebeuren voordat een object dat al in beweging is, zijn snelheid of richting verandert?  Welke van deze items behoort niet tot een apparatuur geometriden brilhandschoenen?
Welke van deze items behoort niet tot een apparatuur geometriden brilhandschoenen?  Waarom sterren met lage massa hoge massa verschillende paden nemen aan het einde van hun leven?
Waarom sterren met lage massa hoge massa verschillende paden nemen aan het einde van hun leven?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


