
Wetenschap
Wat geldt voor spontane reacties bij het denken aan chemische systemen?
Key Concepts
* Spontane reactie: Een reactie die optreedt zonder enige externe invoer van energie. Deze reacties gaan verder in een richting die de algehele stabiliteit van het systeem verhoogt.
* Gibbs Free Energy (ΔG): Een thermodynamische hoeveelheid die de spontaniteit van een reactie voorspelt.
* entropie (δs): Een maat voor wanorde of willekeur binnen een systeem.
* Enthalpy (ΔH): Een maat voor de warmte -energieverandering in een reactie.
Wat waar is aan spontane reacties:
1. Negatieve Gibbs vrije energie (ΔG <0): Het bepalende kenmerk van een spontane reactie. Een negatieve AG geeft aan dat de producten een lagere vrije energie hebben dan de reactanten, waardoor de reactie energetisch gunstig wordt.
2. Verhoogde entropie (AS> 0): Spontane reacties hebben de neiging om de aandoening of willekeur van het systeem te verhogen. Dit betekent niet dat ze altijd leiden tot rommelige producten, maar het algemene systeem wordt minder geordend.
3. kan endotherm of exotherme zijn:
* exotherme reacties (ΔH <0): Laat warmte vrij in de omgeving en draagt bij aan spontaniteit.
* Endothermische reacties (ΔH> 0): Absorbeer warmte uit de omgeving. Om deze reacties spontaan te hebben, moet de toename van entropie groot genoeg zijn om de ongunstige enthalpiewijziging te overwinnen.
4. Niet noodzakelijkerwijs snel: Spontaniteit verwijst naar de neiging van de reactie om op te treden, niet de snelheid ervan. Sommige spontane reacties gebeuren zeer langzaam vanwege hoge activeringsenergiebarrières.
belangrijke overwegingen
* Voorwaarden zijn belangrijk: Spontaniteit kan afhankelijk zijn van temperatuur, druk en concentratie. Een reactie kan spontaan zijn onder de ene set aandoeningen en niet-spontaan onder een andere.
* evenwicht: Hoewel een spontane reactie de productvorming bevordert, betekent dit niet dat de reactie tot voltooiing gaat. Uiteindelijk wordt een staat van evenwicht bereikt waar de snelheden van voorwaartse en omgekeerde reacties gelijk zijn.
Laat het me weten als u specifieke voorbeelden wilt verkennen of dieper in de thermodynamische principes achter spontane reacties wilt duiken.
 De laatste bevindingen over de MOSAiC ijsschots
De laatste bevindingen over de MOSAiC ijsschots Tropische bossen in de bergen van Afrika slaan meer koolstof op dan eerder werd gedacht, maar verdwijnen snel
Tropische bossen in de bergen van Afrika slaan meer koolstof op dan eerder werd gedacht, maar verdwijnen snel 3D-beeldvorming om Amerikaanse erfgoedsites te beschermen tegen orkanen en natuurrampen
3D-beeldvorming om Amerikaanse erfgoedsites te beschermen tegen orkanen en natuurrampen Milieuvernuft:deze creatieve zakelijke ideeën zijn bedoeld om zowel duurzaam als succesvol te zijn
Milieuvernuft:deze creatieve zakelijke ideeën zijn bedoeld om zowel duurzaam als succesvol te zijn Waarom draait de aarde om zich heen?
Waarom draait de aarde om zich heen?
Hoofdlijnen
- Proces met welke twee of meer soorten veranderen als reactie op elkaar wordt aangeroepen?
- Zijn de zijkanten van het DNA -molecuul opgesteld herhalende stikstofbases en suikers?
- Wat is er van plastic gemaakt?
- Wat is DNA en het belang ervan?
- Onderzoekers beschrijven hoe duplicaties van DNA-segmenten het 3D-structuurgenoom beïnvloeden
- Wat is de wetenschap die probeert machines te produceren die hetzelfde type intelligentie vertonen dat mensen doen?
- Twee menselijke eiwitten blijken van invloed te zijn op de manier waarop het 'springende gen' zich verspreidt
- Slechte E. coli kennen we, maar goede coli?
- Wat zijn de basisvaardigheden in de wetenschap?
- Onderzoekers verbeteren de mechanische eigenschappen van aluminium/stalen verbindingen
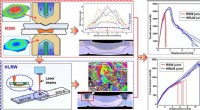
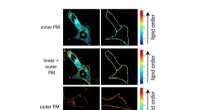
- Lipidenasymmetrie speelt een sleutelrol bij het activeren van immuuncellen
- Bestrijding van schimmelinfecties met metalen

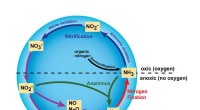
- De fijne kneepjes van de stikstofcyclus onderzoeken
- Aangeraakt door licht:Foto-geëxciteerde stannylanionen zijn geweldig voor het produceren van organotinverbindingen

 Welk punt van de planeet is het dichtst bij de zon?
Welk punt van de planeet is het dichtst bij de zon?  Waar is de zwaartekrachtlijn van het menselijk lichaam?
Waar is de zwaartekrachtlijn van het menselijk lichaam?  Hoeveel keer groter is de diameter vergeleken met
Hoeveel keer groter is de diameter vergeleken met  Zijn goud en platina reactieve metalen?
Zijn goud en platina reactieve metalen?  Wat zijn energie die stoffen oplevert?
Wat zijn energie die stoffen oplevert?  Riviermensen:leven langs de belangrijkste waterwegen van Azië
Riviermensen:leven langs de belangrijkste waterwegen van Azië Wat wordt een ijzige gesneden vallei verdronken door invallen van de zee die wordt genoemd?
Wat wordt een ijzige gesneden vallei verdronken door invallen van de zee die wordt genoemd?  Zuid-Afrika is niet langer het uithangbord voor het verstrekken van toegang tot veilig water
Zuid-Afrika is niet langer het uithangbord voor het verstrekken van toegang tot veilig water
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

