
Wetenschap
Waarom is chloor een gasbromine vloeistof en jodium vast bij kamertemperatuur?
* chloor (Cl₂): Chloor is een gas bij kamertemperatuur omdat de moleculen bij elkaar worden gehouden door zwakke van der Waals Forces . Deze krachten komen voort uit tijdelijke schommelingen in de elektronenverdeling rond het molecuul, wat resulteert in zwakke attracties. Omdat deze krachten zwak zijn, zijn chloormoleculen gemakkelijk gescheiden en bestaan ze als een gas.
* bromine (br₂): Bromine is een vloeistof bij kamertemperatuur omdat de moleculen sterkere van der Waals krachten hebben vergeleken met chloor. Dit komt door de grotere grootte van broomatomen, wat leidt tot grotere elektronenwolkschommelingen en sterkere tijdelijke dipolen.
* jodium (i₂): Jodium is een vaste stof bij kamertemperatuur omdat de moleculen de sterkste van der Waals -krachten ervaren Onder de drie halogenen. Jodiumatomen zijn zelfs groter dan broomatomen, wat resulteert in nog sterkere tijdelijke dipolen en sterkere attracties tussen moleculen.
Key Takeaway: Terwijl je de halogeengroep af gaat, neemt de grootte van de atomen toe, wat leidt tot sterkere Van der Waals -krachten en een verschuiving van gasvorming naar vloeistof naar vaste toestanden bij kamertemperatuur.
 Opinie:Trumps dreigement op toezeggingen over klimaatverandering zal Afrika hard treffen
Opinie:Trumps dreigement op toezeggingen over klimaatverandering zal Afrika hard treffen Klimaatmodel toont droogte in Noord- en Zuid-Amerika tegelijkertijd tijdens La Niña-evenementen
Klimaatmodel toont droogte in Noord- en Zuid-Amerika tegelijkertijd tijdens La Niña-evenementen Kenmerken die sprinkhanen & rivierkreeften Share
Kenmerken die sprinkhanen & rivierkreeften Share De kloof tussen weer en klimaat overbruggen
De kloof tussen weer en klimaat overbruggen Wat is de grootste bijdrage van planten die leven op aarde leven?
Wat is de grootste bijdrage van planten die leven op aarde leven?
Hoofdlijnen
- Hoe kunstmatige intelligentie de illegale handel in wilde dieren kan helpen voorkomen
- Wat is de relatie tussen stikstofbasen en de genetische code?
- Het Y-chromosoom verdwijnt – dus wat zal er met mannen gebeuren?
- Kwallen veranderen van hinderlijk in nuttig product
- Waarom zijn enzymen nodig om chemische reacties met cellen te regelen?
- Wat zijn de belangrijkste functies van eenvoudige koolhydraten in levende wezens?
- Ware of valse vacuolen zijn de krachtpatsers van cellen?
- Het volgende antioxidant-superfood? Canadese duindoornbessen bieden potentieel voor diabetes en obesitas
- Dinosaurussen:jong, volwassen of senior?
- Op zoek naar de meest effectieve polymeren voor persoonlijke beschermingsmiddelen

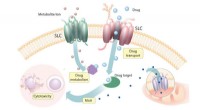
- Nieuwe relaties ontdekken tussen SLC's en cytotoxische geneesmiddelen in menselijke cellen
- Een sprong in het gebruik van silicium voor batterijanoden
- Analyseren van de voor- en nadelen van twee composietproductiemethoden

- Een radicale oplossing komt van het mengen van gereedschappen

 Wat is de naam voor samengestelde Cu2o?
Wat is de naam voor samengestelde Cu2o?  Heeft windenergie een positieve of negatieve impact op de aarde?
Heeft windenergie een positieve of negatieve impact op de aarde?  Hoe wordt een waterlichaam gevormd door gletsjerbeweging?
Hoe wordt een waterlichaam gevormd door gletsjerbeweging?  Is deze samengestelde KPO4 -oplosbaar of onoplosbaar in water?
Is deze samengestelde KPO4 -oplosbaar of onoplosbaar in water?  Opnieuw klonen van de eerste gekloonde hond die tot nu toe als succesvol werd beschouwd
Opnieuw klonen van de eerste gekloonde hond die tot nu toe als succesvol werd beschouwd Hoe carbonaten zich gedragen in het binnenste van de aarde
Hoe carbonaten zich gedragen in het binnenste van de aarde  Natuurkundigen creëren exotische elektronenvloeistof
Natuurkundigen creëren exotische elektronenvloeistof Zuid-Amerikaanse spinvrouwtjes kiezen hun partners op basis van hoe goed het huwelijksgeschenk is ingepakt
Zuid-Amerikaanse spinvrouwtjes kiezen hun partners op basis van hoe goed het huwelijksgeschenk is ingepakt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

