
Wetenschap
Wat is de evenwichtige vergelijking voor KCLO3 voor kaliumchloride en zuurstof?
2 KCLO3 → 2 KCL + 3 O2
Hier is de uitsplitsing:
* reactant: 2 moleculen kaliumchloraat (KCLO3)
* Producten: 2 moleculen kaliumchloride (KCL) en 3 moleculen zuurstofgas (O2)
Verklaring:
* het evenwicht tussen de vergelijking: De vergelijking wordt in evenwicht gebracht door ervoor te zorgen dat het aantal atomen van elk element hetzelfde is aan beide zijden van de vergelijking.
* Er zijn 2 kaliumatomen, 2 chlooratomen en 6 zuurstofatomen aan beide zijden van de vergelijking.
Deze reactie is een voorbeeld van een ontledingsreactie , waarbij een enkele verbinding uiteenvalt in twee of meer eenvoudigere stoffen. Het is ook een endotherm -reactie , wat betekent dat het warmte vereist om verder te gaan.
Hoofdlijnen
- Technologie verhoogt melkgift met 9 procent
- Waar zijn enzymen die het zetmeel afbreken gevonden?
- Wat is een eigenschap heeft twee allelen die worden weergegeven door p en q als 0,89 wat q is?
- Verschillende diëten van bonobogroepen kunnen inzicht bieden in de manier waarop cultuur tot stand komt
- Welke aminozuren zijn gemeenschappelijk voor alle levende systemen?
- Eerste onderzoek dat aantoont dat pesticiden morfologische veranderingen bij gewervelde dieren kunnen veroorzaken
- Nieuwe hypothese:waarom bacteriën steeds resistenter worden tegen antibiotica
- Dacht over wat procesgen uit het ene organisme kunnen worden gecombineerd met een ander organisme?
- Plastics, ziekteverwekkers en babyvoeding:wat zit er in uw schelpdieren?
- Een nieuw MXene-materiaal vertoont een buitengewoon afschermend vermogen tegen elektromagnetische interferentie

- Iridium en 2-methylfenantroline versnellen katalytische boryleringsreacties

- Elektrolytboost verbetert de prestaties van waterige dual-ion-batterijen

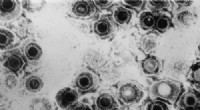
- Cryo-elektronenmicroscopie onthult gemeenschappelijke herpesvirusstructuur
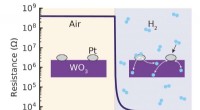
- Een waterstofsensor die werkt bij kamertemperatuur
 De 10 langste bruggen ter wereld
De 10 langste bruggen ter wereld  Hoe vind je de molaire geleidbaarheid van NaCl bij oneindige verdunning wanneer Geleadivity Licl Nano3 en Lino3 gegeven?
Hoe vind je de molaire geleidbaarheid van NaCl bij oneindige verdunning wanneer Geleadivity Licl Nano3 en Lino3 gegeven?  Gewone schimmel helpt het knokkelkoortsvirus te gedijen bij muggen
Gewone schimmel helpt het knokkelkoortsvirus te gedijen bij muggen Studie onthult twee schrijvers die historische inscripties hebben geschreven in Samaria uit de achtste eeuw v.Chr
Studie onthult twee schrijvers die historische inscripties hebben geschreven in Samaria uit de achtste eeuw v.Chr Welke invloed heeft de aardevolutie op zijn seizoenen?
Welke invloed heeft de aardevolutie op zijn seizoenen?  Welke 2 manieren waarop elektrische lading kan worden geproduceerd?
Welke 2 manieren waarop elektrische lading kan worden geproduceerd?  Zuid-Afrika heeft nog een lange weg te gaan over het recht op voedsel
Zuid-Afrika heeft nog een lange weg te gaan over het recht op voedsel Waarom doen mensen de Amerikaanse wetenschap?
Waarom doen mensen de Amerikaanse wetenschap?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


