
Wetenschap
Wat is de moleculaire geometrie van fosfor pentachloride?
Dit is waarom:
* centraal atoom: Fosfor (P) is het centrale atoom.
* valentie -elektronen: Fosfor heeft 5 valentie -elektronen en elk chlooratoom draagt 1 valentie -elektron bij, voor een totaal van 10 valentie -elektronen.
* elektronenparen: Deze 10 elektronen vormen 5 bindparen, alle enkele bindingen tussen fosfor en de vijf chlooratomen.
* Geometrie: De vijf bindingsparen regelen zich in een trigonale bipyramidale vorm. Deze vorm heeft drie chlooratomen in een driehoekig vlak rond de fosfor, met de andere twee chlooratomen boven en onder dit vlak.
Belangrijke opmerking: De werkelijke structuur van PCL5 is complexer dan een eenvoudige trigonale bipyramide. Het wordt beter omschreven als een "vervormde" trigonale bipyramide, waarbij de axiale P-Cl-bindingen langer zijn dan de equatoriale P-CL-bindingen vanwege de grotere afstoting tussen de axiale chlooratomen.
 Onderzoekers ontwikkelen betaalbare, minder intensief methaandetectieprotocol
Onderzoekers ontwikkelen betaalbare, minder intensief methaandetectieprotocol Paasstormen razen naar het zuiden, minstens 20 mensen vermoorden
Paasstormen razen naar het zuiden, minstens 20 mensen vermoorden Impact van het klimaat op de rivierchemie in de Verenigde Staten
Impact van het klimaat op de rivierchemie in de Verenigde Staten Vijf niveaus van de biosfeer
Vijf niveaus van de biosfeer Voel je je alleen in je eco-angst? Niet doen - het is opmerkelijk gebruikelijk om angst te voelen over achteruitgang van het milieu
Voel je je alleen in je eco-angst? Niet doen - het is opmerkelijk gebruikelijk om angst te voelen over achteruitgang van het milieu
Hoofdlijnen
- Kan iemand zich herinneren dat hij geboren is?
- Wat is basispaaraffiniteit?
- Wat laat het celmembraan in en uit?
- Hoe ziet een DNA -model eruit?
- Wat is de Lewis-structuur voor HgI2?
- Wat zijn de aanpassingen van bladepidermale cellen?
- The Stages of the Human Decomposition Process
- Wat is het eindproduct van de glycolyse in erytrocyten?
- Wat is dycariotische reproductie?
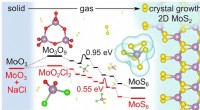
- Bestudeer details waarom 2D-vorming van molybdeendisulfide een snelheidsboost krijgt van zout
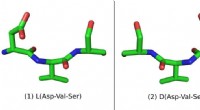
- Door de spiegel:nieuwe spiegelbeeldmoleculen kunnen leiden tot betere medicijnen
- Microscoop voor mobiele telefoons detecteert de stille moordenaar van honingbijen

- Een röntgenfoto maken van een atoombinding

- Met trucs voor materiaalverwerking kunnen ingenieurs nieuw lasermateriaal maken

 Beschrijf twee manieren om geothermische energie te gebruiken?
Beschrijf twee manieren om geothermische energie te gebruiken?  Worden cellen geproduceerd uit niet-levende materialen?
Worden cellen geproduceerd uit niet-levende materialen?  Total CEO zegt dat de olieprijs de komende maanden $ 100 kan bereiken
Total CEO zegt dat de olieprijs de komende maanden $ 100 kan bereiken Inzicht in de chemische communicatie tussen cellen
Inzicht in de chemische communicatie tussen cellen  Hoe kan een zaklamp tegelijkertijd zowel lichtgevend als niet-lichtgevend zijn?
Hoe kan een zaklamp tegelijkertijd zowel lichtgevend als niet-lichtgevend zijn?  Jonge vrouwen worden dubbel hard getroffen door recessies, vooral deze
Jonge vrouwen worden dubbel hard getroffen door recessies, vooral deze Glassige stollingsrotsen vormen zich wanneer magma te snel afkoelt voor minerale granen om te groeien?
Glassige stollingsrotsen vormen zich wanneer magma te snel afkoelt voor minerale granen om te groeien?  Hoeveel gram gelijk aan halve liter?
Hoeveel gram gelijk aan halve liter?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

