
Wetenschap
Een monster van 2.9990 g van een nieuwe verbinding is geanalyseerd en bevond zich de volgende massa's elementen koolstof 1.1610 waterstof 0.29240 zuurstof 1.5455 Bereken empirische formule?
1. Converteer massa naar mollen
* koolstof: (1.1610 g c) / (12.011 g / mol c) =0,09666 mol c
* waterstof: (0,29240 g h) / (1,008 g / mol H) =0,2900 mol H
* zuurstof: (1.5455 g o) / (15.9994 g / mol O) =0,09659 mol O
2. Zoek de eenvoudigste molratio
Verdeel elke molwaarde door de kleinste molwaarde (0,09659 mol O in dit geval):
* koolstof: 0,09666 mol C / 0,09659 mol O ≈ 1
* waterstof: 0,2900 mol H / 0,09659 mol O ≈ 3
* zuurstof: 0,09659 mol O / 0,09659 mol O ≈ 1
3. Schrijf de empirische formule
De empirische formule vertegenwoordigt de eenvoudigste verhouding van het hele nummer van atomen in de verbinding. Op basis van de molverhoudingen is de empirische formule ch₃o .
 Als 2 anders gevormde objecten beide van koper zouden zijn gemaakt, zou de dichtheid anders zijn?
Als 2 anders gevormde objecten beide van koper zouden zijn gemaakt, zou de dichtheid anders zijn?  Onderzoekers schetsen de huidige stand van zaken in de technologie van kalium-ionbatterijen
Onderzoekers schetsen de huidige stand van zaken in de technologie van kalium-ionbatterijen Wat zou er gebeuren met de entropie in reactie 2O3 g 3O2 g?
Wat zou er gebeuren met de entropie in reactie 2O3 g 3O2 g?  Supercondensator met snoepriet kan snel opladen van mobiele telefoons mogelijk maken
Supercondensator met snoepriet kan snel opladen van mobiele telefoons mogelijk maken Welke kleur ontstaat door het mengen van rode en gele pigmenten?
Welke kleur ontstaat door het mengen van rode en gele pigmenten?
 Hoe hevige herfst- en winterwinden de branden in Californië voeden
Hoe hevige herfst- en winterwinden de branden in Californië voeden  Welke term beschrijft de mogelijkheid om objectdetails te onderscheiden en op afstand te vormen?
Welke term beschrijft de mogelijkheid om objectdetails te onderscheiden en op afstand te vormen?  Wat is het proces dat observatie en experimenten gebruikt om kennis op te doen over regelmatigheden in de natuur?
Wat is het proces dat observatie en experimenten gebruikt om kennis op te doen over regelmatigheden in de natuur?  Miljoenen jaren van roetafzettingen onthullen natuurbrandcycli die verband houden met klimaatverandering
Miljoenen jaren van roetafzettingen onthullen natuurbrandcycli die verband houden met klimaatverandering Nepal probeert record met een Dode Zee van plastic zakken
Nepal probeert record met een Dode Zee van plastic zakken
Hoofdlijnen
- Welk apparaat is een afgeplatte stapel buisvormige membranen die eiwitten wijzigt en verpakt in blaasjes die ze naar andere organellen of uit de cel transporteren?
- Het geheim van een lang leven? Vraag een geelbuikmarmot
- Lijst van aseksueel reproducerende organismen
- Antropologen beschrijven derde orang-oetansoort
- Hoe verdedigen tuinbouwgewassen zich tegen schimmelpathogenen?
- Welke suiker is nodig voor cellulaire ademhaling?
- Wat is medicijnen en waar komt het vandaan?
- Hoe een 'antibioticum' bacteriën helpt eten
- Wat is de wetenschappelijke naam van vuuralgen?
- Filter kan een match zijn voor fracking water

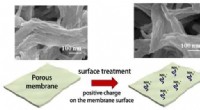
- Ontwikkeling van ultradun duurzaam membraan voor efficiënte scheiding van olie en water
- Test op levensbedreigend voedingstekort wordt gemaakt van ingewanden van bacteriën

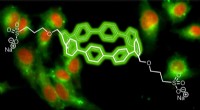
- Chemici maken circulaire fluorescerende kleurstoffen voor biologische beeldvorming
- Programmeerbare zachte actuatoren tonen het grote potentieel van zachte robotica

 Bosbrand in Australië raast door monumentaal eiland
Bosbrand in Australië raast door monumentaal eiland Hoe Polytropic Efficiency te berekenen
Hoe Polytropic Efficiency te berekenen Effecten van de mens op zoetwaterecosystemen
Effecten van de mens op zoetwaterecosystemen Wat is universeel pH-papier?
Wat is universeel pH-papier?  Klein printen, zeer nauwkeurige objecten in een kwestie van seconden
Klein printen, zeer nauwkeurige objecten in een kwestie van seconden Wat is de definitie van natuur essay?
Wat is de definitie van natuur essay?  Waar ben je? Een overzicht van Facebook's plaatsen
Waar ben je? Een overzicht van Facebook's plaatsen  Welke verbinding vertegenwoordigt het aluminiumjodide?
Welke verbinding vertegenwoordigt het aluminiumjodide?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

