
Wetenschap
Welke elementen zouden reageren met twee natriumatrium om een ionische samengestelde calciumzuurstof of stikstof te vormen?
Inzicht in ionische verbindingen
Ionische verbindingen vormen zich wanneer een metaal (zoals natrium) elektronen overbrengt naar een niet -metaal, waardoor positief geladen ionen (kationen) en negatief geladen ionen (anionen) ontstaan. Deze tegengestelde ladingen trekken aan en vormen een sterke elektrostatische binding.
natrium (na)
* Natrium bevindt zich in groep 1 van de periodieke tabel, wat betekent dat het één valentie -elektron heeft dat het gemakkelijk verliest om een stabiel octet te bereiken. Dit vormt een +1 kation (Na +).
calcium (ca)
* Calcium is in groep 2, wat betekent dat het twee valentie -elektronen heeft die het kan verliezen, waardoor een +2 kation (Ca2 +) wordt gevormd.
zuurstof (O)
* Zuurstof is in groep 16, wat betekent dat het nog twee elektronen nodig heeft om een stabiel octet te bereiken. Het vormt een -2 anion (o2-).
stikstof (n)
* Stikstof is in groep 15, wat betekent dat het nog drie elektronen nodig heeft om een stabiel octet te bereiken. Het vormt een -3 anion (n3-).
het bepalen van de reacties
Om een ionische verbinding te vormen met twee natriumatomen (2NA+), hebben we een niet -metalen nodig die twee elektronen kan accepteren.
* calcium (CA) is geen geschikte keuze. Calcium is een metaal en zal zijn eigen ionische verbindingen vormen.
* stikstof (n) is geen geschikte keuze. Stikstof vereist drie elektronen, dus twee natriumatomen zouden niet voldoende zijn om een neutrale verbinding te vormen.
* zuurstof (O) is de geschikte keuze. Twee natriumatomen (2NA+) kunnen hun elektronen overbrengen naar één zuurstofatoom (O2-) om een neutrale verbinding te vormen:
2NA + O → Na2O (natriumoxide)
Samenvattend: Zuurstof is het enige element uit uw lijst dat kan reageren met twee natriumatomen om een ionische verbinding, natriumoxide (Na2O) te vormen.
 Welke gaswet heeft drukvolume en temperatuur?
Welke gaswet heeft drukvolume en temperatuur?  Welke vindt plaats tijdens een redox -reactie?
Welke vindt plaats tijdens een redox -reactie?  asstof, smog, zuur regengeluid en automatische uitlaatgassen zijn allemaal voorbeelden van ________.?
asstof, smog, zuur regengeluid en automatische uitlaatgassen zijn allemaal voorbeelden van ________.?  Nieuwe relaties ontdekken tussen SLC's en cytotoxische geneesmiddelen in menselijke cellen
Nieuwe relaties ontdekken tussen SLC's en cytotoxische geneesmiddelen in menselijke cellen Is 15 gram zuurstofgas en 22 stikstof een mengsel of verbinding?
Is 15 gram zuurstofgas en 22 stikstof een mengsel of verbinding?
 Klimaatverandering zorgt voor ineenstorting van mariene voedselwebben
Klimaatverandering zorgt voor ineenstorting van mariene voedselwebben Ruimte om te groeien, of groeien in de ruimte - hoe verticale boerderijen klaar kunnen zijn om op te stijgen
Ruimte om te groeien, of groeien in de ruimte - hoe verticale boerderijen klaar kunnen zijn om op te stijgen Wat is de zwakste boom in de wereld?
Wat is de zwakste boom in de wereld?  Wat is de belangrijkste bron van water op aarde?
Wat is de belangrijkste bron van water op aarde?  Waarom kun je geen gele naalden aan de boom vinden?
Waarom kun je geen gele naalden aan de boom vinden?
Hoofdlijnen
- Waar zou je naar kunnen zoeken in een Coleus -blad om te bepalen of fotosynthese zich voordoet?
- Beschrijving van de basisfuncties van enzymen in cellen
- Is een boombiotische factor?
- Wat is de functie van een gestreepte spiercel?
- Welk type macromolecuul fungeert als een identificatiemarkering?
- Wat gebeurt er als nieuwe gegevens de huidige wetenschappelijke verklaringen in Qeustion noemen?
- Voedden primitieve walvisachtigen zich als mariene reptielen?
- Wat veroorzaakt smeren bij elektroforese?
- Wat zijn de belangrijkste functionele kenmerken van alle organismen?
- Vloeibare metalen breken organische brandstoffen af tot ultradunne grafietplaten
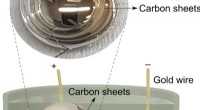
- Nieuwe gel beschermt eieren - en misschien ooit koppen - tegen schade

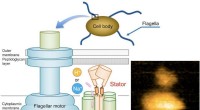
- Onderzoekers beschrijven mechanisme achter flagellaire motiliteit
- Warmtegeleidend plastic kan leiden tot lichtere elektronica, auto's

- Plastic transparanter maken en tegelijkertijd elektrische geleidbaarheid toevoegen

 Hoe verschillen chemische eigenschappen van veranderingen?
Hoe verschillen chemische eigenschappen van veranderingen?  DC Generator Vs. dynamo
DC Generator Vs. dynamo  Wat is de koolstofformule?
Wat is de koolstofformule?  Waarom vormen de d-blokelementen complexen?
Waarom vormen de d-blokelementen complexen?  NASA geeft orkaan Eugene oogonderzoek in oostelijke Stille Oceaan
NASA geeft orkaan Eugene oogonderzoek in oostelijke Stille Oceaan Geweldsmisdrijven stijgen in warmere winters
Geweldsmisdrijven stijgen in warmere winters Gewapende drones, irisscanners:Chinese hightech beveiligingsgadgets
Gewapende drones, irisscanners:Chinese hightech beveiligingsgadgets Volgens de tweede wet van de thermodynamica die een vereiste is voor thermische energiestroom van koudere objecten hete objecten?
Volgens de tweede wet van de thermodynamica die een vereiste is voor thermische energiestroom van koudere objecten hete objecten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

